题目内容
在常温下10mL pH=10的KOH溶液中,加人一定量的pH=4的一元酸HA溶液至pH刚好等于7,则对反应后溶液的叙述正确的是( )
| A、c(HA)+c(A-)=10-4mol/L |
| B、c(H+)=c(OH-)<c(K+)<c(A-) |
| C、V总≤20mL |
| D、酸和碱一定恰好中和 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:
分析:pH=10的KOH溶液,c(OH-)=0.0001mol/L,pH=4的一元酸HA溶液若强酸,c(H+)=c(HA)=0.0001mol/L,混合后pH=7,则等体积混合;若酸为弱酸,c(HA)>0.0001mol/L,混合后pH=7时,应为醋酸和醋酸钾的混合溶液,其体积应小于10mL,以此来解答.
解答:
解:A、pH=10的KOH溶液,c(OH-)=0.0001mol/L,pH=4的一元酸HA溶液若强酸,c(H+)=c(HA)=0.0001mol/L,混合后pH=7,则等体积混合;若酸为弱酸,c(HA)>0.0001mol/L,故A错误;
B、溶液pH=7,则c(OH-)=c(H+),由电荷守恒可知,c(H+)+c(K+)=c(OH-)+c(A-),则c(A-)=c(K+),故B错误;
C、pH=10的KOH溶液,c(OH-)=0.0001mol/L,pH=4的一元酸HA溶液若强酸,c(H+)=c(HA)=0.0001mol/L,混合后pH=7,则等体积混合;若酸为弱酸,c(HA)>0.0001mol/L,混合后pH=7时,应为醋酸和醋酸钾的混合溶液,其体积应小于10mL,即V总≤20mL,故C正确;
D、溶液中显性离子浓度大于隐性离子浓度,所以c(A-)=c(K+)>c(OH-)=c(H+),若酸是强酸完全反应,弱酸则碱过量,故D错误;
故选C.
B、溶液pH=7,则c(OH-)=c(H+),由电荷守恒可知,c(H+)+c(K+)=c(OH-)+c(A-),则c(A-)=c(K+),故B错误;
C、pH=10的KOH溶液,c(OH-)=0.0001mol/L,pH=4的一元酸HA溶液若强酸,c(H+)=c(HA)=0.0001mol/L,混合后pH=7,则等体积混合;若酸为弱酸,c(HA)>0.0001mol/L,混合后pH=7时,应为醋酸和醋酸钾的混合溶液,其体积应小于10mL,即V总≤20mL,故C正确;
D、溶液中显性离子浓度大于隐性离子浓度,所以c(A-)=c(K+)>c(OH-)=c(H+),若酸是强酸完全反应,弱酸则碱过量,故D错误;
故选C.
点评:本题考查酸碱混合溶液的计算,明确酸的强弱及电荷守恒是解答本题的关键,注意酸为弱酸时浓度大,其体积应小于碱的体积才能满足混合溶液的pH=7,题目难度中等.

练习册系列答案
相关题目
生活中下列处理方法正确的是( )
| A、冬天在汽车水箱中加乙二醇抗冻 |
| B、蚂蚁叮咬的红肿处涂沫苯酚止痒 |
| C、纺织品上的油渍用烧碱溶液清洗 |
| D、把铁器具浸入水中隔绝空气防生锈 |
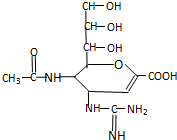 已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性.其分子结构如图:下列说法正确的是( )
已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性.其分子结构如图:下列说法正确的是( )| A、该物质的分子式为C12H19N4O7 |
| B、在一定条件下,该物质可以发生消去、加成、取代等反应 |
| C、1mol该物质与NaOH溶液反应,可以消耗4molNaOH |
| D、该物质能使溴水或高锰酸钾溶液褪色,能与FeCl3溶液发生显色反应 |
工业上,用辉铜矿(Cu2S)炼铜的方法之一是:①将矿石在高温下鼓入空气煅烧,生成两种氧化物;②将煅烧过的矿石加上比它质量约少一半的未经煅烧过的矿石,混合后隔绝空再进行高温煅烧,结果得到铜和一种有刺激性气味的气体.下列对反应①和②的推断不正确的是( )
| A、反应①和②的氧化产物都是S02 |
| B、反应①的氧化产物与还原产物物质的量之比为1:1 |
| C、等物质的量的硫化亚铜在反应①和②中完全反应,转移的电子数相等 |
| D、反应②中,硫化亚铜既是氧化剂又是还原剂 |

 A、B、C是中学化学中常见的单质,常温下甲、乙两种化合物分别是黑色固体和无色液体,这些化合物和单质之间有如图所示关系.据此判断:
A、B、C是中学化学中常见的单质,常温下甲、乙两种化合物分别是黑色固体和无色液体,这些化合物和单质之间有如图所示关系.据此判断: A、B、C、D、E五种元素均为短周期元素,原子序数逐渐增大,A元素原子的核外电子数、电子层数和最外层电子数均相等.B、C、D、E三种元素在周期表中相对位置如表,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、C、D三种元素中的若干种组成(只有M分子同时含有三种元素),其中甲、乙为非金属单质,W由A和C组成,分子中含有18个电子,X分子含有10个电子,它们之间的相互转化关系如图:
A、B、C、D、E五种元素均为短周期元素,原子序数逐渐增大,A元素原子的核外电子数、电子层数和最外层电子数均相等.B、C、D、E三种元素在周期表中相对位置如表,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、C、D三种元素中的若干种组成(只有M分子同时含有三种元素),其中甲、乙为非金属单质,W由A和C组成,分子中含有18个电子,X分子含有10个电子,它们之间的相互转化关系如图: