题目内容
19. 理论上讲,任何自发的氧化还原反应都可以设计成原电池.
理论上讲,任何自发的氧化还原反应都可以设计成原电池.(1)请利用反应“Cu+2Ag+═2Ag+Cu2+”在右图方框中设计一个化学电池,指明电池的正负极材料及电解质溶液,并标出电子流动的方向.
(2)该电池的负极反应式为Cu-2e-=Cu2+;
(3)若导线上转移电子2.5mol,则正极生成银27克.
(4)若原电池的总反应为Cu+2Fe3+═2Fe2++Cu2+,则此电池的正极反应式为Fe3++e-=Fe2+.
分析 (1)根据原电池的电池反应确定正负极及电解质溶液,电子从负极流向正极;
(2)根据正负极上发生反应的反应类型写出电极反应式;
(3)根据转移电子与银的关系式计算生成银的质量;
(4)电池的正极上发生得电子的还原反应,据此书写.
解答 解:(1)根据反应方程式知,选铜、银作电极材料,硝酸银溶液作电解质溶液,电子从负极流向正极,电子流向如图箭头所示,该装置图为: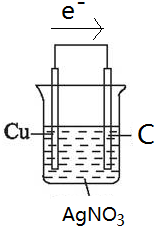 ;
;
(2)根据电极材料的活泼性判断正负极,较活泼的铜作负极,失去电子变成离子进入溶液,该电池的负极反应式为,故答案为:Cu-2e-=Cu2+;
(3)若导线上转移电子2.5mol,设:正极生成银质量是x,
Cu+2AgNO3 =Cu(NO3)2 +2Ag 转移电子
(2×108)g 2mol
x 2.5mol
$\frac{2×108}{x}=\frac{2}{2.5}$,解得x=27g,故答案为:27;
(4)若原电池的总反应为Cu+2Fe3+═2Fe2++Cu2+,此电池的正极上发生得电子的还原反应,即反应式为Fe3++e-=Fe2+,故答案为:Fe3++e-=Fe2+.
点评 原电池的构成条件:
1、有两种活泼性不同的金属(或其中一种为非金属导体)作电极;
2、电极均需插入电解质溶液中;
3、两极相互连接(或接触);
4、能自发地发生氧化还原反应.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
7.下列物质中,只含有共价键的是( )
| A. | Na2O | B. | CO2 | C. | KCl | D. | NaOH |
4.苯最初是从煤焦油中回收,大约从1865年开始了工业生产.随着它用途的扩大,到1930年已经成为世界十大吨位产品之一.将苯分子的一个碳原子换成一个氮原子,得到一个类似于苯环结构的稳定有机物,此有机物的相对分子量为( )
| A. | 81 | B. | 80 | C. | 79 | D. | 78 |
11.碳酸有两个电离常数Ki1、Ki2,分别对应碳酸的两步电离.关于Ki1和Ki2说法正确的是( )
| A. | Ki1的表达式为Ki1=$\frac{c({H}_{2}C{O}_{3})}{C({H}^{+})•C(HC{{O}_{3}}^{-})}$ | |
| B. | Ki2对应的电离过程是HCO3-+H2O≒H2CO3+OH- | |
| C. | 当碳酸的电离平衡正向移动时,Ki1与Ki2均相应增大 | |
| D. | 改变条件使Ki1减小,则Ki2一定也减小 |
8.下列关于苯的说法中错误的是( )
| A. | 苯是一种无色、有特殊气味的液体 | |
| B. | 苯在空气中燃烧有浓烟 | |
| C. | 苯不能使酸性KMnO4溶液褪色 | |
| D. | 苯与浓硝酸混合立即剧烈反应生成硝基苯 |
9.在BaCl2溶液中通入SO2气体,溶液仍澄清.若将BaCl2溶液分别盛在两支试管,一支加HNO3,另一支加NaOH溶液,再通入SO2气体,结果两支试管均有白色沉淀.由此,下列结论合理的是( )
| A. | BaCl2有两性 | |
| B. | 两试管沉淀均是BaSO3 | |
| C. | SO2有还原性,酸性 | |
| D. | 升高PH,使SO2水溶液中SO32-浓度增大 |
 ;
; ;
;