题目内容
3.下列各组物质,无氢气放出的是( )| A. | 铝和氢氧化钠溶液 | B. | 镁和盐酸 | ||
| C. | Cu和稀硫酸 | D. | Si和NaOH溶液 |
分析 选项中只有Cu与稀硫酸不反应,活泼金属与酸反应生成氢气,Al与NaOH溶液反应生成氢气,Si与NaOH溶液反应生成氢气,以此来解答.
解答 解:A.铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,故A不选;
B.Mg与盐酸反应生成氯化镁和氢气,故B不选;
C.由金属活泼性可知,Cu与稀硫酸不反应,故C选;
D.Si和NaOH溶液反应生成硅酸钠和氢气,故D不选;
故选C.
点评 本题考查物质的性质,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握物质的性质、发生的反应及元素化合物知识为解答该题的关键,难度不大.

练习册系列答案
相关题目
1.我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示.下列说法正确的是( )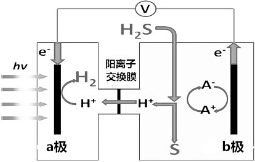

| A. | 该制氢工艺中光能最终转化为化学能 | |
| B. | 该装置工作时,H+由a极区流向b极区 | |
| C. | b极上发生的电极反应为Fe3++e-═Fe2+ | |
| D. | b极区需不断补充含Fe3+和Fe2+的溶液 |
11.下列各组离子在水溶液中能大量共存的是( )
| A. | H+、Na+、CO32- | B. | Ba2+、SO42-、Cl- | C. | K+、H+、OH- | D. | Ag+、Al3+、NO3- |
8.已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为283 kJ | |
| B. | 图可表示由CO生成CO2的反应过程和能量关系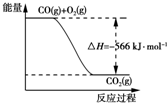 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H=-452 kJ•mol-1 | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为1.204×1024 |
15.下列叙述正确的是( )
| A. | 常温常压下,1.5 mol NO2的体积约为33.6 L | |
| B. | NaOH的摩尔质量是40 g | |
| C. | 100 mL水中溶解了8.4 g NaHCO3,则溶液中Na+的物质的量浓度为1 mol/L | |
| D. | 同温同压下,相同体积的C12和SO2气体所含的分子数一定相同 |
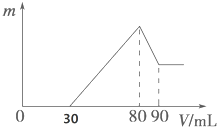 把一定质量的镁、铝混合物投入到1mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入1mol,•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则:
把一定质量的镁、铝混合物投入到1mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入1mol,•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则: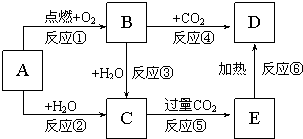 图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.它们的焰色反应均为黄色.请填写下列空白:
图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.它们的焰色反应均为黄色.请填写下列空白: