题目内容
14.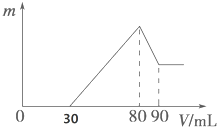 把一定质量的镁、铝混合物投入到1mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入1mol,•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则:
把一定质量的镁、铝混合物投入到1mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入1mol,•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则:(1)写出下列各段反应的离子方程式
①0-30mLH++OH-=H2O
②30-80mLMg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓
③80-90mLAl(OH)3+OH-=[Al(OH)4]-
(2)原溶液中盐酸的体积为80mL
(3)原镁铝混合物中镁、铝的物质的量之比为1:1.
分析 根据图可知,加入氢氧化钠溶液后首先发生的反应是中和过量的酸:H++OH-=H2O,总共消耗了30mL氢氧化钠溶液;30-80段是沉淀两种金属离子:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,80-90是Al(OH)3的溶解:Al(OH)3+OH-=[Al(OH)4]-,从横坐标80mL到90mL这段可计算出n[Al(OH)3]=1mol/L×(0.09L-0.08L)=0.01mol,则n(Al)=n[Al(OH)3]=0.01mol,所以沉淀Al3+需要的OH-为0.03mol,即消耗NaOH溶液的体积为30mL,则沉淀镁离子消耗氢氧化钠溶液的体积为:80mL-30mL-30mL=20mL,据此可计算出镁离子的物质的量,结合质量守恒可知换混合物中Mg的物质的量,据此进行解答.
解答 解:(1)①根据图可知,0-30mL加入氢氧化钠溶液后,首先发生的反应是中和过量的酸:H++OH-=H2O,
故答案为:H++OH-=H2O;
②30-80段是沉淀镁离子、铝离子离子,反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,
故答案为:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓;
③80-90mL是Al(OH)3的溶解,反应的离子方程式为:Al(OH)3+OH-=[Al(OH)4]-,
故答案为:Al(OH)3+OH-=[Al(OH)4]-;
(2)加入80mL氢氧化钠溶液时沉淀达到最大量,此时溶质为NaCl,根据质量守恒可知:n(HCl)=n(NaCl)=n(NaOH)=1mol/L×0.08L=0.08mol,
则原元素溶液的体积为:$\frac{0.08mol}{1mol/L}$=0.08L=80mL,
故答案为:80;
(3)从横坐标80mL到90mL这段可计算出n[Al(OH)3]=1mol/L×(0.09L-0.08L)=0.01mol,则n(Al)=n[Al(OH)3]=0.01mol,所以沉淀Al3+需要的OH-为0.03mol,即消耗NaOH溶液的体积为30mL,则沉淀镁离子消耗氢氧化钠溶液的体积为:80mL-30mL-30mL=20mL,氢氧化钠的物质的量为:1mol/L×0.02L=0.02mol,根据质量守恒定律可知:n(Mg)=$\frac{1}{2}$n(NaOH)=0.01mol,
所以原镁铝混合物中镁、铝的物质的量之比为0.01mol:0.01mol=1:1,
故答案为:1:1.
点评 本题考查了混合物反应的计算、离子反应的计算,题目难度中等,明确图象曲线变化对应反应原理为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |

| A. | 铜片上有气泡产生 | B. | 锌片逐渐溶解 | ||
| C. | 溶液逐渐变蓝 | D. | 电流计指针发生偏转 |
| A. | 铝和氢氧化钠溶液 | B. | 镁和盐酸 | ||
| C. | Cu和稀硫酸 | D. | Si和NaOH溶液 |
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径10-9m~10-7 m | |
| B. | 胶体在生物界普遍存在,应用也很广泛 | |
| C. | 用平行光照射氢氧化铁胶体产生一条光路,是由于光照使之发生分解生成氧化铁 | |
| D. | 氢氧化铁胶体净水是利用了胶体的吸附性 |