题目内容
7.PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOX、O3、CH2=CH-CHO,HCOOH,CH3COOONO2(PAN)等二次污染物.下列说法正确的是( )| A. | N2O结构式可表示为N=N=O | |
| B. | O3分子呈直线形 | |
| C. | CH2=CH-CHO分子中碳原子均采用sp2杂化 | |
| D. | 相同压强下,HCOOH沸点比CH3OCH3高,说明前者是极性分子,后者是非极性分子 |
分析 A.N20与CO2是等电子体,结构相似;
B.O3与SO2是等电子体,结构相似;
C.CH2=CH-CHO分子中每个碳原子均形成三根共价键,均采用sp2杂化;
D.HCOOH分子间能形成氢键;CH30CH3不能形成分子间氢键;
解答 解:A.N20与CO2是等电子体,CO2的结构式O=C=O,所以N20结构式可表示为N=N=O,故A正确;
B.O3与SO2是等电子体,SO2是V形分子,所以O3分子呈V形,故B错误;
C.CH2=CH-CHO分子中每个碳原子均形成三根共价键,均采用sp2杂化,故C正确;
D.HCOOH分子间能形成氢键;CH30CH3不能形成分子间氢键,所以相同压强下,HCOOH沸点比CH30CH3高,故D错误;
故选:AC.
点评 本题是道综合题,涉及的知识点有分子空间构型、等电子体的运用、化学键、杂化类型等,知识点多,但题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
17.设NA为阿伏伽德罗常数的数值,下列叙述正确的是( )
| A. | 0.05mol Na2O2固体中含有的阴离子数为0.05NA | |
| B. | 标准状况下,2.24L CH4所含的原子数为0.5NA | |
| C. | 1molSO2与足量O2在一定条件下反应,共转移2NA个电子 | |
| D. | 1L0.1mol•L-1氨水中含有的NH3•H2O分子数为0.1NA |
18.下表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
(1)元素⑥的名称为氮;⑨的最高价含氧酸的化学式为HBrO4.
(2)①和⑦两种元素的原子按1:1组成的常见化合物的结构式为H-O-O-H.
(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为Cl-、O2-、Mg2+、Al3+.(用离子符号表示)
(4)②、④的最高价氧化物的水化物之间发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(5)用电子式表示③和⑨组成的化合物的形成过程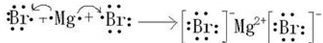 .
.
(6)海带中含有⑩元素,海带灰中含有该元素的简单阴离子,在硫酸酸化下,可用双氧水将其氧化为单质.写出该反应的离子方程式2H++H2O2+2I-=2H2O+I2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | ① | |||||||
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑨ | |||||||
| 5 | ⑩ |
(2)①和⑦两种元素的原子按1:1组成的常见化合物的结构式为H-O-O-H.
(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为Cl-、O2-、Mg2+、Al3+.(用离子符号表示)
(4)②、④的最高价氧化物的水化物之间发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(5)用电子式表示③和⑨组成的化合物的形成过程
 .
.(6)海带中含有⑩元素,海带灰中含有该元素的简单阴离子,在硫酸酸化下,可用双氧水将其氧化为单质.写出该反应的离子方程式2H++H2O2+2I-=2H2O+I2.
15.同温同压下,KMnO4、KClO3、H2O2分解产生相同体积的氧气,三个反应中转移的电子数之比为( )
| A. | 1:1:l | B. | 1:1:2 | C. | 2:2:1 | D. | 4:3:2 |
16.实验室进行下列实验时,一定不需要使用“沸石”的是( )
| A. | 制乙酸丁酯 | B. | 分馏石油 | C. | 制取乙烯 | D. | 溴乙烷的水解 |
17.下列实验“操作”“现象”与“结论”都正确的是( )
| 1 | 操作 | 现象 | 结 论 |
| A | 向白色AgCl悬浊液中滴加0.1mol/LKI溶液 | 试管中白色沉淀转化为黄色沉淀. | Ksp(AgCl)>Ksp(AgI) |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4 | 溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | 向Na2SiO3溶液中滴加盐酸 | 溶液变浑浊 | 非金属性:Cl>Si |
| D | SO2通入足量的稀Fe(NO3)3溶液 | 溶液由棕黄色变为浅绿色,后立即又变成棕黄色 | 氧化性:HNO3>H2SO4>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |

 +NaOH→
+NaOH→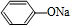 +H2O.
+H2O. ;
;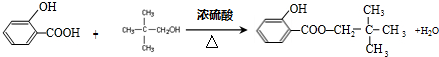 .
.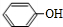 +
+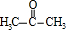 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$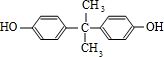 +H2O由D生成N的反应类型是缩聚反应
+H2O由D生成N的反应类型是缩聚反应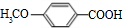 .
.