题目内容
15.在恒温、密闭容器中投入一定量的CaCO3发生分解反应:CaCO3(s)?CaO(s)+CO2(g)△H>0达到平衡时,测得体系中气体的压强为P.若温度不变,缩小体积至原来的一半,重新达到平衡.下列说法的错误是( )| A. | 当CaCO3的浓度不再变化时,表明达到平衡状态 | |
| B. | 重新达到新平衡时,CO2的压强为P | |
| C. | 扩大容器体积,重新达到平衡时n(CO2)增多 | |
| D. | 常温常压下CaCO3的分解反应不一定自发 |
分析 保持温度不变,缩小容器体积,增大压强,向逆反应方向移动,由反应的化学平衡常数K=c(CO2)可知,如温度不变,则达到平衡时二氧化碳的浓度不变,压强不变,以此解答该题.
解答 解:A.碳酸钙为固体,无论是否达到平衡状态,浓度都不变,故A错误;
B.平衡向逆反应方向移动,但温度不变,平衡常数不变,氧气浓度不变,其压强不变,故B正确;
C.扩大容器体积,平衡正向一定,则重新达到平衡时n(CO2)增多,故C正确;
D.生成气体,△S>0,则常温下△H-T•△S不一定小于0,不一定能自发进行,故D正确.
故选A.
点评 本题考查化学平衡的影响因素,为高频考点,侧重考查学生的分析能力,明确化学平衡常数和气体浓度之间的关系是解本题关键,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.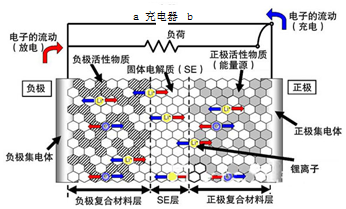 新一代全固体锂离子电池使用硫化物固体电解质,利用薄层成膜技术和加压成型技术,提高了材料颗粒间的离子传导性,从而实现了无需机械加压的充放电.电池的工作原理为:LiMO2+nC$?_{充电}^{放电}$ Li1-xMO2+LixCn (M可以是Co、Ni、Fe等),内部结构如图所示.下列有关说法正确的是( )
新一代全固体锂离子电池使用硫化物固体电解质,利用薄层成膜技术和加压成型技术,提高了材料颗粒间的离子传导性,从而实现了无需机械加压的充放电.电池的工作原理为:LiMO2+nC$?_{充电}^{放电}$ Li1-xMO2+LixCn (M可以是Co、Ni、Fe等),内部结构如图所示.下列有关说法正确的是( )
 新一代全固体锂离子电池使用硫化物固体电解质,利用薄层成膜技术和加压成型技术,提高了材料颗粒间的离子传导性,从而实现了无需机械加压的充放电.电池的工作原理为:LiMO2+nC$?_{充电}^{放电}$ Li1-xMO2+LixCn (M可以是Co、Ni、Fe等),内部结构如图所示.下列有关说法正确的是( )
新一代全固体锂离子电池使用硫化物固体电解质,利用薄层成膜技术和加压成型技术,提高了材料颗粒间的离子传导性,从而实现了无需机械加压的充放电.电池的工作原理为:LiMO2+nC$?_{充电}^{放电}$ Li1-xMO2+LixCn (M可以是Co、Ni、Fe等),内部结构如图所示.下列有关说法正确的是( )| A. | 电池放电时,负极发生的反应为:nC+xLi++xe-═LixCn | |
| B. | 充电器的a端接电源的负极,b端接电源的正极 | |
| C. | 电池充电时Li+自左向右移动 | |
| D. | 电池工作时,固体电解质因熔融而导电 |
10.化学与社会、科学、技术、环境(STSE)密切联系.下列说法正确的是( )
| A. | 干燥剂硅胶和硅橡胶的主要化学成分都是二氧化硅 | |
| B. | 手机外壳上贴的碳纤维外膜是一种新型无机非金属材料 | |
| C. | 用淀粉溶液可以直接检验海水中是否含碘元素 | |
| D. | 明矾净水的原理和“84”消毒液消毒的原理相同 |
7.有机物的结构简式如下,关于该有机物的下列叙述不正确的是( )
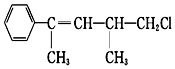
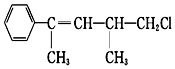
| A. | 在加热和催化剂作用下,最多能与4 mol H2反应 | |
| B. | 能使溴水褪色 | |
| C. | 不能使KMnO4酸性溶液褪色 | |
| D. | 一定条件下,能发生取代反应 |
4.O2和O3是氧元素的两种结构不同的单质,1mol O2转化为O3时要吸收94.73kJ的热能.下列说法正确的是( )
| A. | O3比O2稳定 | |
| B. | O2和O3是氧的两种核素,互称同素异形体 | |
| C. | O2和O3的相互转化是化学变化 | |
| D. | 在标准状况下,等体积的O2和O3含有相同数目的氧原子 |
5.一定条件下的可逆反应2NO2 (红棕色)?2NO (无色)+O2 (无色),在恒压密闭容器充入NO2,达到化学平衡状态的标志是( )
| A. | 反应停止了 | |
| B. | NO的正反应速率与O2的逆反应速率相等 | |
| C. | c(NO):c(O2)=2:1 | |
| D. | 气体的颜色不再变化 |
 B.
B. C.
C. D.
D.
 废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末. ;D微粒的核外电子排布式为1s2 2s22p6 3s23p6.
;D微粒的核外电子排布式为1s2 2s22p6 3s23p6.