题目内容
15.下列物质在生活中有广泛应用,其中不属于离子化合物的是( )| A. | NO | B. | Ca(ClO)2 | C. | NaCl | D. | NaHCO3 |
分析 含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,一般来说,活泼金属和活泼非金属元素之间易形成离子键.
解答 解:A.NO分子中N原子和O原子之间存在共价键,为共价化合物,不是离子化合物,故A正确;
B.Ca(ClO)2中钙离子和次氯酸根离子之间存在离子键,为离子化合物,故B错误;
C.NaCl中钠离子和氯离子之间存在离子键,为离子化合物,故C错误;
D.NaHCO3中钠离子和碳酸氢根离子之间存在离子键,为离子化合物,故D错误;
故选A.
点评 本题考查了化合物和化学键的关系,明确基本概念是解本题关键,根据化合物中存在的化学键确定化合物类型,题目难度不大.

练习册系列答案
相关题目
2.氯化亚铜(CuCl,白色、易氧化,Ksp=1.2×10-6)广泛用作催化剂、脱臭剂、脱色剂等.工业上用初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备活性CuCl的流程如图:
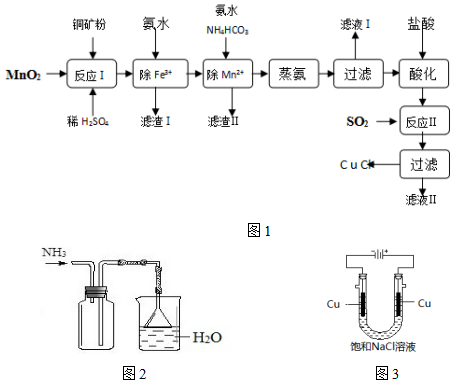
(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S+MnO2+H2SO4→CuSO4+S+MnSO4+H2O(未配平)
氧化产物为:CuSO4、S
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液.Cu(OH)2+4NH3?[Cu(NH3)4]2++2OH-
蒸氨条件及蒸氨效果见表
由表中信息可知蒸氨的条件应选c(填序号).蒸出的氨可以回收利用,在实验室用图2装置来收集当集气瓶收集满氨时观察到的现象是漏斗中的液面忽上忽下.
(4)反应Ⅱ的离子方程式SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO42-+4H+.
(5)实验证明通过图3装置也可获得CuCl,现象为
阴极:产生无色气体
阳极:有白色胶状沉淀生成且逐渐增多
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀,
①生成CuCl的电极反应式为Cu-e-+Cl-=CuCl↓.
②有同学提出说:淡黄色沉淀可能是CuOH,以下是从资料中查阅到的有关CuOH信息,哪些可以支持该同学的说法bd.(填序号)
a.容易脱水变成红色的Cu2O.
b.CuOH是黄色或淡黄色固体,不溶于水
c.价格:240元/Kg
d.CuOH的Ksp=2×10-15
e.易被氧化成Cu(OH)2.

(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S+MnO2+H2SO4→CuSO4+S+MnSO4+H2O(未配平)
氧化产物为:CuSO4、S
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液.Cu(OH)2+4NH3?[Cu(NH3)4]2++2OH-
蒸氨条件及蒸氨效果见表
| 序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
| a | 110 | 60 | 101.3 | 浅蓝色 |
| b | 100 | 40 | 74.6 | 几乎很浅 |
| c | 90 | 30 | 60.0 | 无色透明 |
(4)反应Ⅱ的离子方程式SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO42-+4H+.
(5)实验证明通过图3装置也可获得CuCl,现象为
阴极:产生无色气体
阳极:有白色胶状沉淀生成且逐渐增多
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀,
①生成CuCl的电极反应式为Cu-e-+Cl-=CuCl↓.
②有同学提出说:淡黄色沉淀可能是CuOH,以下是从资料中查阅到的有关CuOH信息,哪些可以支持该同学的说法bd.(填序号)
a.容易脱水变成红色的Cu2O.
b.CuOH是黄色或淡黄色固体,不溶于水
c.价格:240元/Kg
d.CuOH的Ksp=2×10-15
e.易被氧化成Cu(OH)2.
3.已知甲、乙、丙、丁四种可溶于水的化合物所含的离子如下表所示.用pH试纸检测得知甲、乙两种水溶液呈酸性,丙的水溶液呈中性,丁的水溶液呈碱性,下列有关说法中正确的是( )
| 阳离子 | Al3+、Ba2+ |
| 阴离子 | OHˉ、SO42ˉ、Clˉ |
| A. | 往甲和乙的混合溶液中加入过量的丁溶液一定会生成白色沉淀 | |
| B. | 丙和丁的水溶液混合后会生成白色沉淀 | |
| C. | 一定温度下,丙溶于水会使水的电离程度增大 | |
| D. | 一定温度下,甲溶于水会使水的电离程度减小 |
10.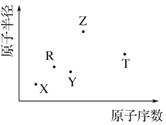 短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )
短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )
 短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )
短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 最高价氧化物对应水化物的酸性:T<R | |
| C. | 氢化物的沸点不一定是:Y>R | |
| D. | 由 X、R、Y、Z 四种元素组成的化合物水溶液一定显碱性 |
7.运动会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应为5KClO3+6P=3P2O5+5KCl.下列有关该反应的叙述不正确的是( )
| A. | KClO3是氧化剂 | B. | P2O5是氧化产物 | ||
| C. | 1molKClO3参加反应有6mole-转移 | D. | 每有6molP被还原,生成5molKCl |
4.最近我国“人造太阳”研究获重大进展.核聚变中下列质子数小于中子数的原子是( )
| A. | ${\;}_{1}^{2}$H | B. | ${\;}_{1}^{3}$H | C. | ${\;}_{2}^{4}$He | D. | ${\;}_{1}^{1}$H |
5.X、Y、Z、M、W五种主族元素分属三个短周期,且原子序数依次增大.X、Z同族,可形成离子化合物ZX;Y′、M同主族,可形成MY2、MY3两种分子.下列说法中正确的是( )
| A. | 原子半径的大小:W>Z>X | |
| B. | 气态氢化物的还原性:Y>M | |
| C. | 最高价氧化物的水化物的酸性:M>W | |
| D. | X与Y可形成10电子分子和18电子分子 |
 .
. 铝及其化合物在生产和生活等方面有广泛的应用.请回答下列问题:
铝及其化合物在生产和生活等方面有广泛的应用.请回答下列问题:
