题目内容
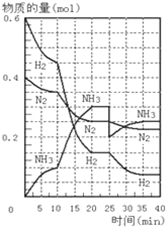 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )| A、反应开始到第一次平衡时,N2的平均反应速率为0.0625mol?(L?min)-1,H2的转化率为75% |
| B、反应达到第一次平衡时,反应的平衡常数表达式可写作:K=c2(NH3)/[c3(H2)?c(N2)]=(0.15 mol?L-1)2/[(0.075 mol?L-1)3?(0.125 mol?L-1)] |
| C、从曲线变化可以看出,反应进行到10min至20min时可能采取的措施是使用了催化剂 |
| D、从曲线变化可以看出,反应进行至25min时,采取的措施是分离出0.1mol的氨气,平衡正向移动 |
考点:化学平衡的计算,化学平衡的影响因素
专题:
分析:A.第一次平衡时,时间为20min,氮气的物质的量由0.4mol变为0.25mol,容器容积为2L,根据速率公式可计算出氮气的速率;
B.反应达到第一次平衡时,c(NH3)=
=0.15mol/L,c(H2)=
=0.075mol/L,c(N2)=
=0.125mol/L,然后根据平衡常数表达式计算;
C.根据图象知,平衡向正反应方向移动,10min时是连续的,三种气体物质的速率增加倍数相同,说明为使用催化剂;
D.25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3;
B.反应达到第一次平衡时,c(NH3)=
| 0.3mol |
| 2L |
| 0.15mol |
| 2L |
| 0.25mol |
| 2L |
C.根据图象知,平衡向正反应方向移动,10min时是连续的,三种气体物质的速率增加倍数相同,说明为使用催化剂;
D.25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3;
解答:
解:A.第一次平衡时,时间为20min,氮气的物质的量由0.4mol变为0.25mol,容器容积为2L,v(N2)=
=0.00375mol/(L?min),故A错误;
B.反应达到第一次平衡时,c(NH3)=
=0.15mol/L,c(H2)=
=0.075mol/L,c(N2)=
=0.125mol/L,
K=(0.15 mol?L-1)2/[(0.075 mol?L-1)3?(0.125 mol?L-1)],故B正确;
C.由图象可知各组分物质的量变化增加,且10min时变化是连续的,20min达平衡时,△n(N2)=0.4-0.25=0.15mol,△n(H2)=0.6mol-0.15mol=0.45mol,△n(NH3)=0.3mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,故C正确;
D.25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3,故D正确;
故选A.
| 0.4mol-0.25mol |
| 2L×20min |
B.反应达到第一次平衡时,c(NH3)=
| 0.3mol |
| 2L |
| 0.15mol |
| 2L |
| 0.25mol |
| 2L |
K=(0.15 mol?L-1)2/[(0.075 mol?L-1)3?(0.125 mol?L-1)],故B正确;
C.由图象可知各组分物质的量变化增加,且10min时变化是连续的,20min达平衡时,△n(N2)=0.4-0.25=0.15mol,△n(H2)=0.6mol-0.15mol=0.45mol,△n(NH3)=0.3mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,故C正确;
D.25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3,故D正确;
故选A.
点评:本题考查化学平衡的计算、平衡移动以及平衡状态的判断,题目难度中等,注意对图象的分析.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
相同物质的量的 CO 和 CO2 相比较,下列叙述正确的是( )
①分子数之比为1:1
②所含氧原子数之比为1:2
③原子总数之比为2:3
④碳原子数之比为1:1
⑤电子数之比为7:11
⑥体积之比为1:1.
①分子数之比为1:1
②所含氧原子数之比为1:2
③原子总数之比为2:3
④碳原子数之比为1:1
⑤电子数之比为7:11
⑥体积之比为1:1.
| A、①③④ | B、②③④ |
| C、①②③④⑤ | D、①②③④⑤⑥ |
下列有关表述正确的是( )
A、次氯酸的电子式: |
B、N原子的电子排布图: |
| C、二氧化硅的分子式:SiO2 |
| D、氯原子的价电子排布式:3s23p5 |
下列关于浓硫酸和浓硝酸的叙述不正确的是( )
| A、加热条件下均能与碳反应 |
| B、长期露置在空气中浓度均会降低 |
| C、常温下均不能用铁制容器贮存 |
| D、一定条件下均可与铜片反应 |
 ,若要检验出其中的碳碳双键,其方法是
,若要检验出其中的碳碳双键,其方法是
