题目内容
有A、B、C、D、E五种元素,它们可能是原子或离子,且为短周期元素,A与B可形成BA型化合物,且A元素是非金属性最强的元素.金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8个;C元素有三种同位素C1、C2、C3,自然界里含量最多的是C1,C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍.D的气态氢化物水溶液显碱性,而其最高价氧化物水化物为强酸.E元素原子的最外层电子数比次外层电子数多4个,E离子的核外电子数比质子数多2个.
(1)写出A元素名称: ,C2粒子的符号: .
(2)画出E离子的结构示意图: ,E的最简单氢化物的分子式 .
(3)写出B与E化合的化学方程式: .
(4)写出A的单质、B的单质分别与水反应的溶液混合后发生的反应的离子方程式: .
(5)A与C形成的化合物中含化学键类型是: ,用电子式表示该化合物: .
(1)写出A元素名称:
(2)画出E离子的结构示意图:
(3)写出B与E化合的化学方程式:
(4)写出A的单质、B的单质分别与水反应的溶液混合后发生的反应的离子方程式:
(5)A与C形成的化合物中含化学键类型是:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E五种元素,它们可能是原子或离子,且为短周期元素,A与B可形成BA型化合物,且A元素是非金属性最强的元素,即A为F;金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8个,且B能形成+1价,故B为钠;C元素有三种同位素C1、C2、C3,自然界里含量最多的是C1,C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍,故C是氢;D的气态氢化物水溶液显碱性,而其最高价氧化物水化物为强酸,即D为氮;E元素原子的最外层电子数比次外层电子数多4个,E离子的核外电子数比质子数多2个,故E为氧,据此回答各小题即可.
解答:
解:依据分析可知:A为F,B为钠;C为氢;D为氮,E为氧,
(1)A为F,名称为:氟,H分别能形成同位素:氕、氘、氚,C2为氘,即质量是2,符号为:
H,故答案为:氟; ;
;
(2)E为氧元素,原子得到2个电子形成氧离子,氧离子的结构示意图为: ,O与H形成的最简单氢化物是水,故答案为:
,O与H形成的最简单氢化物是水,故答案为: ;H2O;
;H2O;
(3)钠与氧气常温下化合生成氧化钠,加热条件下生成过氧化钠,反应方程式为:4Na+O2═2Na2O 或2Na+O2
Na2O2,故答案为:4Na+O2═2Na2O 或2Na+O2
Na2O2;
(4)A的单质为F2与水反应生成的溶液为HF的水溶液,B的单质为Na与水反应生成氢氧化钠溶液,HF溶液与氢氧化钠溶液混合后发生酸碱中和反应,HF为弱酸,不能拆,故反应的离子方程式为:HF+OH-=F-+H2O,故答案为:HF+OH-=F-+H2O;
(5)F与H形成的化合物中含极性共价键,H与F之间形成一对共用电子对,故答案为:共价键(极性键); .
.
(1)A为F,名称为:氟,H分别能形成同位素:氕、氘、氚,C2为氘,即质量是2,符号为:
2 1 |
 ;
;(2)E为氧元素,原子得到2个电子形成氧离子,氧离子的结构示意图为:
 ,O与H形成的最简单氢化物是水,故答案为:
,O与H形成的最简单氢化物是水,故答案为: ;H2O;
;H2O;(3)钠与氧气常温下化合生成氧化钠,加热条件下生成过氧化钠,反应方程式为:4Na+O2═2Na2O 或2Na+O2
| ||
| ||
(4)A的单质为F2与水反应生成的溶液为HF的水溶液,B的单质为Na与水反应生成氢氧化钠溶液,HF溶液与氢氧化钠溶液混合后发生酸碱中和反应,HF为弱酸,不能拆,故反应的离子方程式为:HF+OH-=F-+H2O,故答案为:HF+OH-=F-+H2O;
(5)F与H形成的化合物中含极性共价键,H与F之间形成一对共用电子对,故答案为:共价键(极性键);
 .
.
点评:本题主要考查的是元素的推断以及元素化合物的知识,属于常考题.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA |
| B、1 mol Cl2与足量Fe反应,转移的电子数为3NA |
| C、标准状况下,以任意比混合的氢气和一氧化碳气体共8.96 L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA |
| D、7.1 g Cl2与足量的NaOH溶液反应转移的电子数约为0.2 NA |
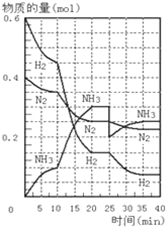 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )| A、反应开始到第一次平衡时,N2的平均反应速率为0.0625mol?(L?min)-1,H2的转化率为75% |
| B、反应达到第一次平衡时,反应的平衡常数表达式可写作:K=c2(NH3)/[c3(H2)?c(N2)]=(0.15 mol?L-1)2/[(0.075 mol?L-1)3?(0.125 mol?L-1)] |
| C、从曲线变化可以看出,反应进行到10min至20min时可能采取的措施是使用了催化剂 |
| D、从曲线变化可以看出,反应进行至25min时,采取的措施是分离出0.1mol的氨气,平衡正向移动 |
下列有关物质类别的判断依据,正确的是( )
| A、胶体:能否产生丁达尔现象 |
| B、离子化合物:是否含有离子键 |
| C、电解质:水溶液是否导电 |
| D、原子晶体:组成微粒是否为原子 |
一些装有化学物质的瓶子上贴有危险警告标签,下面是一些危险警告标签,其中贴法有错误的是( )


| A、A | B、B | C、C | D、D |
两种微粒的核外电子数相同,核电荷数不同,则它们可能是( )
| A、两种不同元素的原子 |
| B、两种所带电荷数相同的离子 |
| C、同一元素的原子和离子 |
| D、两种不同元素的原子和离子 |
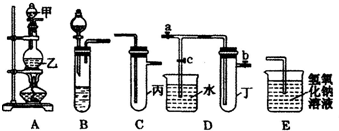 如图5个装置都是中学化学中常见的实验装置,某学习小组的同学欲用这些装置进行常见物质的制取并探究其性质(图中a、b、c表示止水夹),请对其进行完善或评价,试回答下列问题:
如图5个装置都是中学化学中常见的实验装置,某学习小组的同学欲用这些装置进行常见物质的制取并探究其性质(图中a、b、c表示止水夹),请对其进行完善或评价,试回答下列问题: