题目内容
16.用20mL18.4mol•L-1的浓硫酸与铜共热一段时间后,冷却,过滤除去多余的铜,将滤液稀释到100mL,得到溶液中SO42-的浓度为3.18mol•L-1,则此时溶液中CuSO4的物质的量浓度为( )| A. | 0.50mol•L-1 | B. | 0.75mol•L-1 | C. | 1.00mol•L-1 | D. | 3.18mol•L-1 |
分析 20mL 18.4mol•L-1 浓H2SO4的物质的量为0.02L×18.4mol/L=0.368mol,n(SO42-)=0.368mol,反应后n(SO42-)=0.1L×3.18mol•L-1=0.318mol,则减少的n(SO42-)=0.368mol-0.318mol=0.05mol,所以生成二氧化硫为0.05mol,结合Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑分析.
解答 解:20mL 18.4mol•L-1 浓H2SO4的物质的量为:0.02L×18.4mol/L=0.368mol,n(SO42-)=0.368mol,
反应后n(SO42-)=0.1L×3.18mol•L-1=0.318mol,则减少的n(SO42-)=0.368mol-0.318mol=0.05mol,说明反应生成SO2为0.05mol,
由反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑可知,n(CuSO4)=n(SO2)=0.05mol,
则此时溶液中CuSO4的物质的量浓度为:c(CuSO4)=$\frac{0.05mol}{0.1L}$=0.50mol/L,
故选A.
点评 本题考查物质的量浓度的计算,明确减少的硫酸根离子与生成二氧化硫的量的关系是解答本题的关键,注意基本公式的应用,题目难度不大.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
5. 用除去表面氧化膜的细铝条紧紧缠绕在温度计上(如图),将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升.下列分析错误的是( )
用除去表面氧化膜的细铝条紧紧缠绕在温度计上(如图),将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升.下列分析错误的是( )
 用除去表面氧化膜的细铝条紧紧缠绕在温度计上(如图),将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升.下列分析错误的是( )
用除去表面氧化膜的细铝条紧紧缠绕在温度计上(如图),将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升.下列分析错误的是( )| A. | Al和O2化合放出热量 | B. | 硝酸汞是催化剂 | ||
| C. | 涉及了:2Al+3Hg2+→2Al3++3Hg | D. | “白毛”是氧化铝 |
4.光导纤维的主要成分是( )
| A. | 纯硅 | B. | 玻璃 | C. | SiO2 | D. | 沙子 |
11.以酸性氢氧燃料电池为电源进行电解的实验装置如图.下列叙述正确的是( )
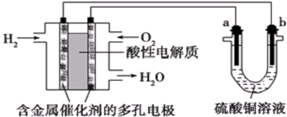

| A. | 燃料电池工作时,正极反应为O2+2H2O+4e-=4OH- | |
| B. | a极是铁,b极是铜时,铁片表面会镀上一层红色的铜 | |
| C. | a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等 | |
| D. | a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
8.某温度时,使用一对石墨电极电解饱和Na2SO4溶液,当转移2mol电子时停止电解,析出Na2SO4•10H2O晶体m g,所有数据都在相同温度下测得,下列叙述正确的是( )
| A. | 电解后溶液质量减少(m+36)g | |
| B. | 原溶液中Na2SO4的质量分数为$\frac{71m}{161(m+18)}$ | |
| C. | 若其它条件不变,将石墨电极替换为铜电极,则阴极析出2mol H2 | |
| D. | 若其它条件不变,将石墨电极替换为铜电极,则析出Na2SO4•10H2O晶体仍为m g |
6.Zn-ZnSO4-PbSO4-Pb电池装置如图,下列说法错误的是( )
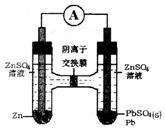

| A. | SO42-从右向左迁移 | |
| B. | 电池的正极反应为:Pb2++2e-═Pb | |
| C. | 左边ZnSO4浓度增大,右边ZnSO4浓度不变 | |
| D. | 若有6.5g锌溶解,有0.1 molSO42-通过离子交换膜 |
 A、B、C、D、E是元素周期表中前36号元素,核电荷数依次增大,A与B能形成种类繁多的化合物,D原子中成对电子数等于未成对电子数的3倍;E+中所有电子正好充满K、L、M三个电子层.
A、B、C、D、E是元素周期表中前36号元素,核电荷数依次增大,A与B能形成种类繁多的化合物,D原子中成对电子数等于未成对电子数的3倍;E+中所有电子正好充满K、L、M三个电子层.
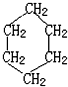 (结构简式).
(结构简式).