题目内容
8.如图曲线的变化趋势完全正确的一组是( )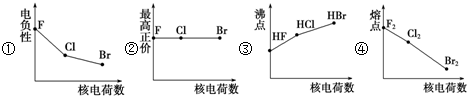
| A. | ①②③④ | B. | ②③④ | C. | ① | D. | ①②③ |
分析 ①非金属性越强,电负性越大;
②F电负性最强,没有最高正化合价;
③HF中存在氢键,导致HF的沸点大于硫化氢、溴化氢;
④卤素单质中,原子序数越大,沸点越高.
解答 解:①F、Cl、Br的非金属性逐渐减小,其电负性逐渐减弱,故①正确;
②F元素没有正化合价,曲线的变化趋势与实际不相符,故②错误;
③HF分子中含有氢键,其分子间作用力大大增加,则HF的沸点大于HCl、HBr,曲线的变化趋势与实际不相符,故③错误;
④随着原子序数的递增,卤素单质的沸点逐渐升高,图象曲线变化与实际不相符,故④错误;
故选C.
点评 本题考查了原子结构与元素周期律的应用、电负性强弱判断,题目难度中等,明确元素周期律内容为解答关键,注意掌握电负性强弱的影响因素,试题侧重考查学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列反应中,属于氧化还原反应且水只作氧化剂的是( )
| A. | SO3+H2O→H2SO4 | B. | Cl2+H2O?HCl+HClO | ||
| C. | 2 F2+2 H2O→4 HF+O2 | D. | 2 Al+6 H2O$\stackrel{△}{→}$2 Al(OH)3+3 H2↑ |
7.下列物质在溶液中电离出的Cl-与1mol CaCl2电离出的Cl-数目相同的是( )
| A. | 2mol KClO3 | B. | 1mol KCl | C. | 1mol Ca(ClO)2 | D. | 2mol NaCl |
3.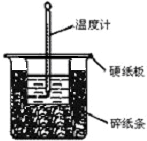 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌器.
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失.
(3)要重复进行三次实验的目的是减少实验误差.
(4)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大、偏小、无影响”);当室温低于10℃时进行,对实验结果会造成较大的误差,其原因是体系内、外温差大,会造成热量损失.
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等、不相等”),简述理由因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关.
(6)用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会偏小;(填“偏大、偏小、无影响”).
(7)三次平行操作所测得的数据如下:
若上述HCl、NaOH溶液的密度都近似为1g/cm3,中和后生成的溶液的比热容C=4.18J/(g•℃),则实验测得的中和热为-39.3kJ/mol.
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌器.
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失.
(3)要重复进行三次实验的目的是减少实验误差.
(4)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大、偏小、无影响”);当室温低于10℃时进行,对实验结果会造成较大的误差,其原因是体系内、外温差大,会造成热量损失.
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等、不相等”),简述理由因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关.
(6)用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会偏小;(填“偏大、偏小、无影响”).
(7)三次平行操作所测得的数据如下:
| 温度 序号 | 起始温度t1/℃ | 终止温度 T2/℃ | 温度差 △t/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 25 | 25 | 27.3 | ||
| 2 | 25 | 25 | 27.4 | ||
| 3 | 25 | 25 | 28.6 | ||
20.下列物质不能使酸性高锰酸钾溶液褪色的是( )
| A. | 乙烯 | B. | 乙醇 | C. | 苯 | D. | 二氧化硫 |
18.下列离子方程式正确的是( )
| A. | 向澄清石灰水中加入盐酸 Ca(OH)2+2H+→Ca2++2H2O | |
| B. | 硫化亚铁与盐酸反应 S2-+2H+→H2S↑ | |
| C. | 氯化铝溶液与过量氨水反应 Al3++3NH3•H2O→Al(OH)3↓+3NH4+ | |
| D. | 氯化亚铁溶液中通入少量氯气 Fe2++Cl2→Fe3++2Cl- |
 小明设计的探究燃烧条件的实验如图所示.请回答下列问题.
小明设计的探究燃烧条件的实验如图所示.请回答下列问题.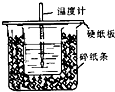 中和热的测量,是一个重要的定量实验.
中和热的测量,是一个重要的定量实验. .
.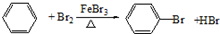 ,反应类型:取代反应.
,反应类型:取代反应.