题目内容
18.下列离子方程式正确的是( )| A. | 向澄清石灰水中加入盐酸 Ca(OH)2+2H+→Ca2++2H2O | |
| B. | 硫化亚铁与盐酸反应 S2-+2H+→H2S↑ | |
| C. | 氯化铝溶液与过量氨水反应 Al3++3NH3•H2O→Al(OH)3↓+3NH4+ | |
| D. | 氯化亚铁溶液中通入少量氯气 Fe2++Cl2→Fe3++2Cl- |
分析 A.澄清石灰水中氢氧化钙拆成离子形式;
B.硫化亚铁为沉淀保留化学式;
C.二者反应生成氢氧化铝沉淀和氯化铵;
D.得失电子不守恒.
解答 解:A.向澄清石灰水中加入盐酸,离子方程式:OH-+H+=H2O,故A错误;
B.硫化亚铁与盐酸反应,离子方程式:FeS+2H+=H2S↑+Fe2+,故B错误;
C.氯化铝溶液与过量氨水反应,离子方程式:Al3++3NH3•H2O→Al(OH)3↓+3NH4+,故C正确;
D.氯化亚铁溶液中通入少量氯气,离子方程式:3Fe2++Cl2=2Fe3++2Cl-,故D错误;
故选:C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意化学式拆分,注意电荷守恒、原子个数守恒.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
8.如图曲线的变化趋势完全正确的一组是( )
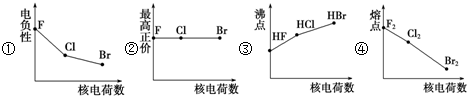

| A. | ①②③④ | B. | ②③④ | C. | ① | D. | ①②③ |
9.下列叙述正确的是( )
| A. | N、O、F元素非金属性依次减弱 | |
| B. | Na、Mg、Al元素最高化合价依次升高 | |
| C. | Na、Li、K原子的电子层数依次增多 | |
| D. | P、Cl、S元素最高价氧化物对应的水化物酸性依次增强 |
6.下列离子在溶液中能常量共存的是( )
| A. | K+ H+ Fe2+ NO3- | B. | H+ Al3+ SO42- Cl- | ||
| C. | Na+ Al3+ HCO3- Cl- | D. | Na+ NH4+ OH- CO32- |
3.下列各组溶液,只用试管和胶头滴管,不用任何试剂就可以鉴别的是( )
| A. | CaCl2、Na2CO3 | B. | Ba(OH)2、NaHSO4 | C. | AlCl3、NH3•H2O | D. | Al2(SO4)3、NaOH |
10.下列有关实验的操作,正确的是( )
| A. | Fe3+ 的水溶液为棕黄色,可用含SCN-的溶液检验 | |
| B. | 用玻璃棒蘸取溶液,滴在湿润的pH试纸上测定溶液的pH值 | |
| C. | 中和滴定用的锥形瓶用待测溶液润洗C | |
| D. | 除去Fe2O3中混有的少量Al2O3可用盐酸 |
7.将两块相同的纯铁片,一片放入冷的浓H2SO4 中浸泡一段时间后,取出洗净,另一片未作任何处理,而后两块铁片分别放入硫酸铜溶液中,则下列说法正确的是( )
| A. | 两块铁片上均有铜析出 | B. | 两块铁片上均无铜析出 | ||
| C. | 浸过浓H2SO4 的铁片上有铜析出 | D. | 浸过浓H2SO4 的铁片上无铜析出 |
8.下列说法正确的是( )
| A. | 所有的酸和碱都能使指示剂变色 | |
| B. | 物质发生缓慢氧化时一定放出热量 | |
| C. | 检测某溶液的pH时,pH试纸要预先用水湿润 | |
| D. | 一氧化碳还原氧化铜后试管壁上留下的红色物质,用稀硫酸浸泡除去 |
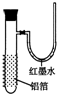
 ,红墨水柱右端上升说明这是一个放热反应.
,红墨水柱右端上升说明这是一个放热反应.