题目内容
元素的性质随着元素原子序数的递增而呈周期性变化的原因是( )
| A、元素原子的核外电子排布呈周期性变化 |
| B、元素的原子半径呈周期性变化 |
| C、元素的化合价呈周期性变化 |
| D、元素的金属性、非金属性呈周期性变化 |
考点:元素周期律的实质
专题:
分析:A、随原子序数的递增,电子层数和最外层电子数都呈现周期性的变化而引起元素性质的周期性变化;
B、元素的原子半径的周期性变化是原子的电子排布周期性变化的结果;
C、元素的最高正化合价的周期性变化是原子的电子排布周期性变化的结果;
D、元素的金属性、非金属性的周期性变化是原子的电子排布周期性变化的结果.
B、元素的原子半径的周期性变化是原子的电子排布周期性变化的结果;
C、元素的最高正化合价的周期性变化是原子的电子排布周期性变化的结果;
D、元素的金属性、非金属性的周期性变化是原子的电子排布周期性变化的结果.
解答:
解:A、由原子的电子排布可知,随原子序数的递增,电子层数和最外层电子数都呈现周期性的变化而引起元素性质的周期性变化,即原子的电子层排布的周期性变化是引起元素性质周期性变化的决定因素,故A正确;
B、元素的原子半径属于元素的性质,元素的原子半径的周期性变化是电子排布周期性变化的结果,故B错误;
C、化合价属于元素的性质,元素的最高正化合价的周期性变化是原子的电子排布周期性变化的结果,故C错误;
D、元素的金属性、非金属性的周期性变化是原子的电子排布周期性变化的结果,故D错误.
故选A.
B、元素的原子半径属于元素的性质,元素的原子半径的周期性变化是电子排布周期性变化的结果,故B错误;
C、化合价属于元素的性质,元素的最高正化合价的周期性变化是原子的电子排布周期性变化的结果,故C错误;
D、元素的金属性、非金属性的周期性变化是原子的电子排布周期性变化的结果,故D错误.
故选A.
点评:随着原子序数的递增,元素原子的核外电子排布的周期性变化导致元素性质(金属性和非金属性,原子半径,化合价等)的周期性变化.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
在核磁共振氢谱中会出现两组峰,其峰面积之比为3:1的化合物是( )
| A、CH3COOH |
| B、HCHO |
| C、CH3CH2OH |
D、 |
已知1-18号元素的离子aW3+、bX+、CY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A、四种元素位于同一周期 |
| B、氢化物的稳定性H2Y>HZ |
| C、离子的氧化性aW3+>bX+ |
| D、a+3<c-2 |
目前人类已发现的非金属除稀有气体外共有16种,下列对这16种非金属元素的相关判断正确的是( )
①都是主族元素,最外层电子数都大于4
②常温下气体单质都是双原子分子
③最高正化合价与最低负化合价代数和为0的元素有3种
④氢化物在常温下都是气态
⑤能形成既含离子键又含共价键的化合物.
①都是主族元素,最外层电子数都大于4
②常温下气体单质都是双原子分子
③最高正化合价与最低负化合价代数和为0的元素有3种
④氢化物在常温下都是气态
⑤能形成既含离子键又含共价键的化合物.
| A、①②④ | B、②③⑤ |
| C、③⑤ | D、①④ |
下列叙述中不正确的是( )
| A、HClO4的酸性比H2SO4强 |
| B、硫化氢的稳定性比氯化氢的强 |
| C、钠与硫化合时生成硫化钠 |
| D、氯气的氧化性比单质硫的强 |
下列分子中,共价键的极性最强的是( )
| A、NH3 |
| B、H2S |
| C、CH4 |
| D、H2O |
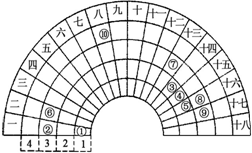 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )| A、②、⑧、⑨对应简单离子半径依次减小 |
| B、⑥的氯化物的熔点比⑦的氯化物熔点低 |
| C、元素⑩处于常见周期表第四周期第VIIIB族 |
| D、①、③、④、⑤形成的某种化合物中既含有共价键又含有离子键 |