题目内容
写出由2-丙醇制取1,2-丙二醇的化学方程式,并注明反应类型.
考点:化学方程式的书写
专题:
分析:醇在浓硫酸的作用下发生消去反应生成烯烃,烯烃与卤素单质发生加成反应生成二卤代烃,二卤代烃在碱性条件下水解生成1,2-丙二醇,据此分析解答.
解答:
解:2-丙醇在浓硫酸作用下发生消去反应,反应的化学方程式为:CH3CHOHCH3
CH3-CH=CH2↑+H2O,
丙烯与溴水加成生成1,2-二溴丙烷,反应方程式为:CH2=CHCH3+Br2→BrCH2CHBrCH3 ,
1,2-二溴丙烷制乙二醇,为卤代烃的水解反应(取代反应),该反应为CH2BrCHBrCH3+2NaOH
CH2OHCHOHCH3+2NaBr,
答:CH3CHOHCH3
CH3-CH=CH2↑+H2O(消去反应),CH2=CHCH3+Br2→BrCH2CHBrCH3 (加成反应),CH2BrCHBrCH3+2NaOH
CH2OHCHOHCH3+2NaBr(取代反应);
| 浓硫酸 |
| 170℃ |
丙烯与溴水加成生成1,2-二溴丙烷,反应方程式为:CH2=CHCH3+Br2→BrCH2CHBrCH3 ,
1,2-二溴丙烷制乙二醇,为卤代烃的水解反应(取代反应),该反应为CH2BrCHBrCH3+2NaOH
| 水 |
| △ |
答:CH3CHOHCH3
| 浓硫酸 |
| 170℃ |
| 水 |
| △ |
点评:本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系及化学反应方程式的书写为解答的关键,注意反应类型的分析与反应条件,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
常温下,将1体积pH=2.5的盐酸与10体积NaOH溶液混合,两者恰好完全反应,则NaOH溶液的pH等于( )
| A、11.5 | B、10.5 |
| C、9.5 | D、9.0 |
下列叙述中不正确的是( )
| A、HClO4的酸性比H2SO4强 |
| B、硫化氢的稳定性比氯化氢的强 |
| C、钠与硫化合时生成硫化钠 |
| D、氯气的氧化性比单质硫的强 |
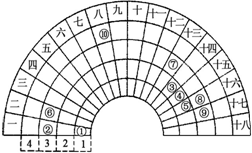 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )| A、②、⑧、⑨对应简单离子半径依次减小 |
| B、⑥的氯化物的熔点比⑦的氯化物熔点低 |
| C、元素⑩处于常见周期表第四周期第VIIIB族 |
| D、①、③、④、⑤形成的某种化合物中既含有共价键又含有离子键 |
 江西某铜业公司在火法炼铜时也生产硫酸,硫酸车间如图.下列叙述不正确的是( )
江西某铜业公司在火法炼铜时也生产硫酸,硫酸车间如图.下列叙述不正确的是( )| A、自然界化合态硫以FeS、CuFeS2等形式存在 |
| B、火法炼铜的矿石原料主要含Cu2S |
| C、该公司炼铜产生的SO2可用于生产H2SO4 |
| D、l mol/L H2SO4溶液可储存于铁制或铝制容器 |
下列各组物质的分类正确的是( )
①混合物:水玻璃、水银、水煤气 ②电解质:明矾、石膏、水
③酸性氧化物:CO2、CO、SO3 ④同位素:1H、2H2、3H
⑤同素异形体:C60、金刚石、石墨 ⑥干冰、液氯都是非电解质.
①混合物:水玻璃、水银、水煤气 ②电解质:明矾、石膏、水
③酸性氧化物:CO2、CO、SO3 ④同位素:1H、2H2、3H
⑤同素异形体:C60、金刚石、石墨 ⑥干冰、液氯都是非电解质.
| A、①②③④⑤⑥ | B、②④⑤⑥ |
| C、②⑤⑥ | D、②⑤ |
某化工厂按如下步骤进行生产:①以煤为燃料煅烧石灰石;②用饱和碳酸钠溶液充分吸收步骤①中产生的二氧化碳;③使步骤①产生的氧化钙跟水反应,④熟石灰与碳酸钠溶液反应.该厂生产过程中涉及的物质有:①石灰石;②纯碱(Na2CO3);③小苏打(NaHCO3);④烧碱;⑤二氧化碳;⑥消石灰;下列叙述正确的是( )
| A、起始原料是①② |
| B、起始原料是②⑥ |
| C、最终产品是④⑤ |
| D、最终产品是③④ |
二甘醇可用作溶剂、纺织助剂等,一旦进入人体会导致急性肾衰竭,危及生命.二甘醇的结构简式是HO-CH2CH2-O-CH2CH2-OH.下列有关二甘醇的叙述正确的是( )
| A、不能与金属钠发生反应 |
| B、能发生取代反应 |
| C、能溶于水,不溶于乙醇 |
| D、符合通式CnH2nO3 |