题目内容
16.同一主族的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性强弱是H3XO4<H3YO4<H3ZO4,下列推断正确的是( )| A. | 原子序数:X<Y<Z | B. | 气态氢化物稳定性:XH3<YH3<ZH3 | ||
| C. | 元素的非金属性强弱:X>Y>Z | D. | 电子层数:X>Y |
分析 同主族元素从上到下元素的非金属性逐渐减弱,对应的最高价氧化物对应水化物的酸性逐渐减弱,根据酸性相对强弱:H3XO4<H3YO4<H3ZO4,可知原子序数的关系为X>Y>Z,根据同主族非金属性的递变规律比较.
解答 解:A.同主族元素从上到下元素的非金属性逐渐减弱,对应的最高价氧化物对应水化物的酸性逐渐减弱,根据酸性相对强弱:H3XO4<H3YO4<H3ZO4,可知原子序数的关系为X>Y>Z,故A错误;
B.元素非金属性越强,则对应氢化物的稳定性越强,则气态氢化物的稳定性:XH3<YH3<ZH3,故B正确;
C.同主族元素从上到下元素的非金属性逐渐减弱,对应的最高价氧化物对应水化物的酸性逐渐减弱,则可知非金属性X<Y<Z,故C错误;
D、同主族元素从上到下元素的非金属性逐渐减弱,对应的最高价氧化物对应水化物的酸性逐渐减弱,电子层数逐渐增多,所以电子层数:Y<X,故D正确.
故选BD.
点评 本题考查了同主族元素性质的相似性和递变性,把握元素周期律为解答本题的关键,注意归纳非金属性比较的方法,题目难度不大.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
6.下列反应属于吸热反应的是( )
| A. | 氯化铵与消石灰反应 | B. | 酸碱中和反应 | ||
| C. | 铝热反应 | D. | 锌与盐酸反应 |
4.肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.
已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1 135.7kJ/mol;
下列说法正确的是( )
已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1 135.7kJ/mol;
下列说法正确的是( )
| A. | N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-1 068 kJ/mol | |
| B. | 肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4+H2O═N2H5++OH- | |
| C. | 铂做电极,以KOH溶液为电解质溶液的肼--空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2+4H2O | |
| D. | 铂做电极,以KOH溶液为电解质溶液的肼--空气燃料电池,工作一段时间后,KOH溶液的pH将增大 |
11.“绿色化学”要求在化工合成过程中,目标产物对反应物的原子利用率达到100%,下列反应类型一定符合这一要求的是( )
| A. | 取代反应 | B. | 加成反应 | C. | 酯化反应 | D. | 氧化反应 |
8.将SO2分别通入下表所列的溶液中,在表格中的空格里填写答案
| 反应物 | 溴水 | 酸性KMnO4溶液 | 氢硫酸(H2S溶液) | 滴有酚酞的NaOH溶液 | 石蕊试液 | 品红溶液 |
| 反应现象 | ||||||
| SO2的性质 |
5.某烃键线式为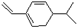 ,该烃以物质的量之比为1:1与Br2加成时,所得产物有( )
,该烃以物质的量之比为1:1与Br2加成时,所得产物有( )
 ,该烃以物质的量之比为1:1与Br2加成时,所得产物有( )
,该烃以物质的量之比为1:1与Br2加成时,所得产物有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
6.工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ•mol-1、-285.8kJ•mol-1和-283.0kJ•mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.
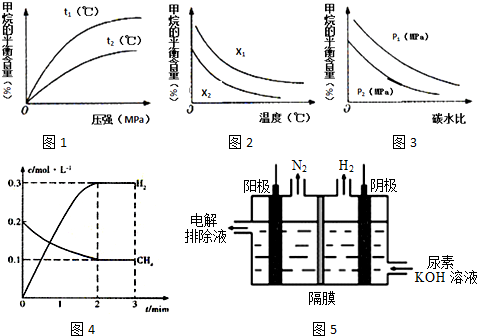
(1)写出甲烷与水蒸气在高温下反应制合成气的热化学方程式CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ•mol-1.
(2)在一定条件下,向体积固定为2L的密闭容器中充入0.40mol CH4(g)和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化的曲线如图4所示.
3min时改变条件,反应进行到t1min时,体系中各物质的物质的量如下表所示:
则3~t1min之间,平衡向正(填“正”或“逆”)反应方向移动,3min时改变的条件是升高温度.
(3)已知温度、压强和碳水比[$\frac{n(C{H}_{4})}{n({H}_{2}O)}$]对该反应的影响如图所示.
①图l中,两条曲线所示温度的关系:t1<t2(填“>”、“<”或“=”,下同).
②图2中,两条曲线所示碳水比的关系:x1>x2.
③图3中,两条曲线所示压强的关系:p1>p2.
(4)氢气也可利用电解尿素制备.电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图5图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.

(1)写出甲烷与水蒸气在高温下反应制合成气的热化学方程式CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ•mol-1.
(2)在一定条件下,向体积固定为2L的密闭容器中充入0.40mol CH4(g)和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化的曲线如图4所示.
3min时改变条件,反应进行到t1min时,体系中各物质的物质的量如下表所示:
| t/min | n(CH4)/mol | n(H2O)/mol | n(CO)/mol | n(H2)/mol |
| t1 | 0.18 | 0.38 | 0.22 | 0.66 |
(3)已知温度、压强和碳水比[$\frac{n(C{H}_{4})}{n({H}_{2}O)}$]对该反应的影响如图所示.
①图l中,两条曲线所示温度的关系:t1<t2(填“>”、“<”或“=”,下同).
②图2中,两条曲线所示碳水比的关系:x1>x2.
③图3中,两条曲线所示压强的关系:p1>p2.
(4)氢气也可利用电解尿素制备.电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图5图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
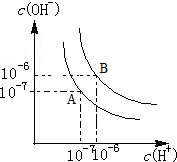 水的电离平衡如图所示.
水的电离平衡如图所示.
 .
. .
. 的合成路线流程图(无机试剂可任选).
的合成路线流程图(无机试剂可任选).