题目内容
7.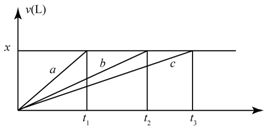 将等物质的量的金属Na、Mg、Al分别于100mL2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况),不正确的是( )
将等物质的量的金属Na、Mg、Al分别于100mL2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况),不正确的是( )| A. | x=2.24 | B. | 钠的物质的量为0.2 mol | ||
| C. | 反应时,Na、Mg、Al均过量 | D. | 曲线b为Mg与盐酸反应的图象 |
分析 由于最后生成的气体量相同,所以这些金属置换出的氢气量相等,即等物质的量的三种金属失去了相同数量的电子,而若盐酸过量的话,这些金属失去的电子数应该是不一样的,比值应是1:2:3,故推断出盐酸不可能过量,但可能刚好和Na反应完全,此时Na完全反应而Mg、Al还有剩余,由此分析.
解答 解:由于最后生成的气体量相同,所以这些金属置换出的氢气量相等,即等物质的量的三种金属失去了相同数量的电子,而若盐酸过量的话,这些金属失去的电子数因该是不一样的,比值应是1:2:3,故推断出盐酸不可能过量,但可能刚好和Na反应完全,此时Na完全反应而Mg、Al还有剩余,
A、由于酸不足,所以生成氢气的量为:n(H2)=$\frac{1}{2}$n(HCl)=$\frac{0.1×2}{2}$=0.1mol,所以标况下的体积为2.24L,故A正确;
B、生成0.1mol的氢气需0.2mol的钠,故B正确;
C、Na不可能过量,即使过量也要与溶剂水反应,故C错误;
D、按照金属活动性顺序,Na>Mg>Al,故中间那条线b是Mg与盐酸反应的图象,故D正确;
故选C.
点评 本题考查钠的性质,注意钠和水反应的特点,根据物质的量的大小可与酸、水反应的特点比较生成氢气的多少,难度不大.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
17.除去MgO中的Al2O3可选用的试剂是( )
| A. | NaOH溶液 | B. | 氨水 | C. | 稀盐酸 | D. | CO气体 |
18.1mol下列气体分别于1L1mol•L-1的KOH溶液反应,形成的溶液pH最小的是( )
| A. | CO2 | B. | H2S | C. | SO2 | D. | SO3 |
2.下列物质能使品红溶液褪色,其中是利用强氧化性来漂白的是( )
①活性炭
②过氧化钠
③氯水
④臭氧.
①活性炭
②过氧化钠
③氯水
④臭氧.
| A. | ①③④ | B. | ②③④ | C. | ①②③④ | D. | ①②③④ |
12.下列有关说法正确的是( )
| A. | 可用量筒量取16.28mL的浓硫酸 | |
| B. | 用托盘天平准确称取2.00g的NaOH固体 | |
| C. | 常温常压下1molO2的质量为32g | |
| D. | 用250mL的容量瓶配制30%的NaCl溶液 |
19.在PH=1的溶液中,能大量共存的是( )
| A. | Fe2+、Cl-、NO3-、Na+ | B. | K+、Cu2+、SO42-、Cl- | ||
| C. | Na+、K+、CO32-、SO42- | D. | Mg2+、SO42-、OH-、NO3- |
10.下表中方程式及评价合理的是( )
| 选项 | 化学反应及离子方程式 | 评价 |
| A | 氧化亚铁溶于稀硝酸FeO+2H+=Fe2++2H2O | 碱性氧化物与酸反应生成盐和水,正确 |
| B | 向亚硫酸氨溶液中加入少量氢氧化钡溶液 Ba2++SO32-=BaSO3↓ | 复分解反应,有沉淀生成,正确 |
| C | 含n mol FeBr2的溶液中通入n mol Cl2完全反应2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | 氧化还原反应离子方程式满足元素守恒、电子守恒、电荷守恒,正确 |
| D | 三氯化铁溶液滴入硫氰化钾溶液:Fe3++3SCN-=Fe(SCN)3 | 复分解反应,无气体生成,无沉淀生成,不正确 |
| A. | A | B. | B | C. | C | D. | D |
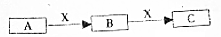 A、B、C是中学化学常见的三种物质.它们之间的相互转化关系如下(部分反条件及反应物产物略去)
A、B、C是中学化学常见的三种物质.它们之间的相互转化关系如下(部分反条件及反应物产物略去)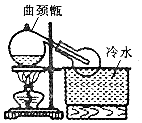 实验室常用浓H2SO4与NaNO3粉末反应制取HNO3,实验装置如图.
实验室常用浓H2SO4与NaNO3粉末反应制取HNO3,实验装置如图.