题目内容
20.下列有关实验设计或操作正确且能达到目的是( )| 选项 | A | B | C | D |
| 实验装置或操作 |  | 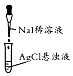 | 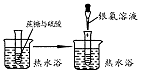 | 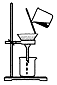 |
| 实验目的 | 配制一定物质的量浓度的稀硫酸 | 悬浊液由白色转为黄色证明Ksp(AgCl)大于Ksp(AgI) | 验证蔗糖在硫酸催化作用下发生水解反应 | 从碳酸氢钠悬浊液中分离出NaHCO3的晶体 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.不能将浓硫酸直接注入容量瓶中;
B.由白色转为黄色,发生沉淀的转化;
C.水解后检验葡萄糖,应在碱性条件下;
D.过滤时漏斗下短紧靠烧杯内壁.
解答 解:A.不能将浓硫酸直接注入容量瓶中,应在烧杯中稀释、冷却后转移,故A错误;
B.由白色转为黄色,发生沉淀的转化,则证明Ksp(AgCl)大于Ksp(AgI),故B正确;
C.水解后检验葡萄糖,应在碱性条件下,图中没有加碱至碱性,再加银氨溶液,则不能检验,故C错误;
D.过滤时漏斗下短紧靠烧杯内壁,图中未紧靠烧杯内壁,操作不合理,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握溶液配制、沉淀转化、有机物的性质及过滤操作为解答本题的关键,侧重分析与实验能力的考查,注意实验装置的作用及实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
10.下表中方程式及评价合理的是( )
| 选项 | 化学反应及离子方程式 | 评价 |
| A | 氧化亚铁溶于稀硝酸FeO+2H+=Fe2++2H2O | 碱性氧化物与酸反应生成盐和水,正确 |
| B | 向亚硫酸氨溶液中加入少量氢氧化钡溶液 Ba2++SO32-=BaSO3↓ | 复分解反应,有沉淀生成,正确 |
| C | 含n mol FeBr2的溶液中通入n mol Cl2完全反应2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | 氧化还原反应离子方程式满足元素守恒、电子守恒、电荷守恒,正确 |
| D | 三氯化铁溶液滴入硫氰化钾溶液:Fe3++3SCN-=Fe(SCN)3 | 复分解反应,无气体生成,无沉淀生成,不正确 |
| A. | A | B. | B | C. | C | D. | D |
8.下列关于浓硝酸和浓硫酸的叙述正确的是( )
| A. | 露置在空气中,容器内酸液的质量都减轻 | |
| B. | 常温下都能与铜较快反应 | |
| C. | 常温下都能与氨气反应 | |
| D. | 加热条件下都能与碳反应 |
5.原子序数依次增大的短周期主族元素A、B、C、D,A元素的一种同位素原子核内无中子;B元素形成的化合物种类最多;C、D元素同主族且最外层电子数为偶数.下列叙述正确的是( )
| A. | A元素形成的双原子分子A2最多有3种 | |
| B. | 化合物BC2的电子式为 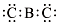 | |
| C. | B、C、D三种元素的非金属性强弱顺序为C>D>B | |
| D. | 化合物A2C的沸点高于A2D是因为C-A键比D-A键稳定 |
12.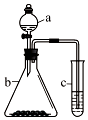 利用如图所示装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测其中现象正确的是( )
利用如图所示装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测其中现象正确的是( )
 利用如图所示装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测其中现象正确的是( )
利用如图所示装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测其中现象正确的是( )| 选项 | a | b | c | c试管中现象 |
| A | 浓盐酸 | KMnO4 | FeCl2溶液 | 溶液变棕黄色 |
| B | 稀硫酸 | Na2S2O3 | 溴水 | 产生浅黄色沉淀 |
| C | 硼酸 | Na2CO3 | Na2SiO3溶液 | 析出白色沉淀 |
| D | 浓硝酸 | 铁片 | KI-淀粉溶液 | 溶液变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
9.下列叙述正确的是( )
| A. | 铜丝能导电,因此它是电解质 | |
| B. | BaSO4难溶于水,因此它是非电解质 | |
| C. | NaC1熔融状态时能导电,因此它是电解质 | |
| D. | 胶体区别于其他分散系的本质是具有丁达尔效应 |
10.如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的关系曲线,下列判断正确的是( )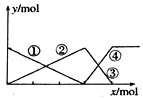

| A. | ①线表示AlO2-的物质的量的变化 | B. | x表示AlCl3的物质的量 | ||
| C. | ③线表示Al(OH)3的物质的量的变化 | D. | ④线表示AlO2-的物质的量的变化 |
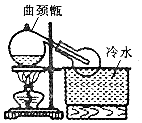 实验室常用浓H2SO4与NaNO3粉末反应制取HNO3,实验装置如图.
实验室常用浓H2SO4与NaNO3粉末反应制取HNO3,实验装置如图.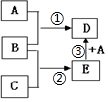 已知A、B、C、D、E均为常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).请回答:
已知A、B、C、D、E均为常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).请回答: