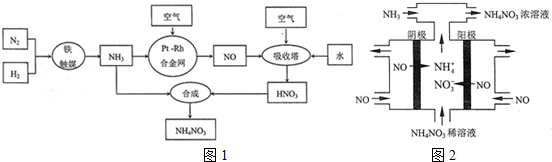
题目内容
16.已知H2S和HNO3可反应生成S、NO和H2O.(1)写出该反应的化学方程式并标出电子转移方向和数目
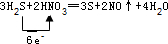 .
.(2)该反应中的还原剂是H2S,该反应中的还原产物是NO.
(3)若反应过程中转移了0.3mol 电子,则生成水的质量是3.6g.
分析 硝酸的氧化性大于硫,所以在该反应中硝酸作氧化剂,在反应中得电子化合价降低,则硫化氢在反应中失电子作还原剂,该反应方程式为3H2S+2HNO3═3S+2NO↑+4H2O,结合化合价变化计算解答.
解答 解:H2S和HNO3可反应生成S、NO和H2O,5种物质发生3H2S+2HNO3═3S+2NO↑+4H2O,
(1)S失去电子,N得到电子,该反应中转移6e-,电子转移的方向和数目为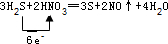 ,故答案为:
,故答案为: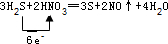 ;
;
(2)S元素的化合价升高,则H2S为还原剂,N元素的化合价降低,得到电子被还原,则还原产物为NO;
故答案为:H2S;NO;
(3)转移6mol电子生成4mol水,则转移了0.3mol电子,则生成水的质量是0.3mol×$\frac{4}{6}$×18g/mol=3.6g,
故答案为:3.6g.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及计算的考查,注意硝酸、硫化氢的性质,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
11.实验室常用NaNO2和NH4Cl加热反应制取N2,其余产物还有NaCl和水.下列有关说法正确的是( )
| A. | NaNO2是还原剂 | |
| B. | NH4Cl中N元素被还原 | |
| C. | 生成1 mol N2时转移6 mol电子 | |
| D. | 氧化剂和还原剂的物质的量之比是1:1 |
1.正确掌握好化学用语是学好化学的基础,下列有关表述正确的是( )
| A. | 质量数为16的氧原子:${\;}_{16}^{8}$O | |
| B. | 苛性钠化学式:Na2CO3 | |
| C. | 镁离子结构示意图: | |
| D. | 次氯酸钠在水中电离:NaClO═Na++Cl-+O2- |
8.将下列两种盐溶液混合时有沉淀生成,继续加稀硝酸沉淀不溶解的是( )
| A. | Cu(NO3)2和KOH | B. | Ca(ClO)2和Na2CO3 | C. | (NH4)2SO4和BaCl2 | D. | K2SO4和Na2CO3 |
5.已知::①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
②Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
②Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
| A. | Na2O2(s)与CO2(g)反应时,放出226kJ热量 | |
| B. | CO的燃烧热为△H=-566kJ/mol | |
| C. | CO(g)与Na2O2 (S)反应的热化学方程式为:Na2O2(s)+CO(g)═Na2CO3(s)△H=-509kJ•mol-1 | |
| D. | 2Na2O2(s)+2CO2(g)═2Na2CO3(s)+O2(g)△H=-452kJ•mol-1 |
10.化学与生活息息相关,下列说法错误的是( )
| A. | 乙烯可作为水果的催熟剂 | |
| B. | 用二氧化碳制全降解塑料,可以缓解温室效应 | |
| C. | 氧化铝陶瓷和光导纤维都属于无机非金属材料 | |
| D. | 丙烷(C3H8)和乙醇(C2H5OH)均存在同分异构体 |
 ,违背了泡利不相容原理.
,违背了泡利不相容原理.