题目内容
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:

依据上图完成下列问题:
(1)在电解过程中,阴极上生成气体的电子式为 .
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为 .
(3)精制过程要除去SO42-,可选择下列溶液中的 (填字母序号)
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去SO42-(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释: .
(5)脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 、 (填操作名称)而制得50%的NaOH溶液.
(6)写出电解饱和食盐水的离子方程式: .

依据上图完成下列问题:
(1)在电解过程中,阴极上生成气体的电子式为
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为
(3)精制过程要除去SO42-,可选择下列溶液中的
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去SO42-(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释:
(5)脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、
(6)写出电解饱和食盐水的离子方程式:
考点:氯碱工业
专题:元素及其化合物
分析:(1)在电解过程中,与电源正极相连的电极发生:2Cl--2e-=Cl2↑,与电源负极相连的电极发生2H++2e-=H2↑;
(2)精制过程就是将杂质离子转化为沉淀除去的过程,Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀;
(3)添加钡试剂除去SO42-,注意不能引入新的杂质;当加入多种除杂试剂时,后面的试剂要为前面的操作去除残余,所以就要注意考虑先后的顺序,为有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后;
(4)依据沉淀溶解平衡平衡移动影响因素分析,结合溶解度分析判断;
(5)根据氢氧化钠和氯化钠的溶解度随温度的变化关系来确定实现氯化钠和氢氧化钠分离获得氯化钠的方法;
(6)电解饱和食盐水生成氯气、氢气和氢氧化钠.
(2)精制过程就是将杂质离子转化为沉淀除去的过程,Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀;
(3)添加钡试剂除去SO42-,注意不能引入新的杂质;当加入多种除杂试剂时,后面的试剂要为前面的操作去除残余,所以就要注意考虑先后的顺序,为有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后;
(4)依据沉淀溶解平衡平衡移动影响因素分析,结合溶解度分析判断;
(5)根据氢氧化钠和氯化钠的溶解度随温度的变化关系来确定实现氯化钠和氢氧化钠分离获得氯化钠的方法;
(6)电解饱和食盐水生成氯气、氢气和氢氧化钠.
解答:
解:(1)电解饱和食盐水的反应:2NaCl+2H2O
2NaOH+Cl2↑+H2↑,与正极相连为阳极,生成氯气,该电极反应为2Cl--2e-═Cl2↑,与电源负极相连为阴极,生成氢气,电极反应式为2H++2e-=H2↑,氢气的电子式为H:H,
故答案为:H:H;
(2)Mg2+和NaOH反应转化为沉淀,离子反应为:Mg2++2OH-═Mg(OH)2↓,
故答案为:Mg2++2OH-═Mg(OH)2↓;
(3)除杂的基本原则是除杂而不引杂,就是不能引入新的杂质.对于该混合物而言,氢氧根离子和氯离子都不是杂质,
而硝酸根离子却是杂质,所以可以选用氢氧化钡,也可以选用氯化钡,但是不能选用硝酸钡,
故答案为:ac;
(4)由于BaSO4比BaCO3的溶解度小,SO42-促使BaCO3(s)?Ba2+(aq)+CO32- (aq)平衡正向移动,生成更难溶的BaSO4沉淀;
故答案为:由于BaSO4比BaCO3的溶解度小,SO42-促使BaCO3(s)?Ba2+(aq)+CO32- (aq)平衡正向移动,生成更难溶的BaSO4沉淀;
(5)氢氧化钠的溶解度随温度的升高而增大,但是氯化钠的溶解度受温度的影响不大,所以氢氧化钠和氯化钠分离的方法是:通过加热蒸发、冷却、结晶、过滤除去NaCl,
故答案为:结晶;过滤;
(6)电解饱和食盐水生成氯气、氢气和氢氧化钠,其反应为2NaCl+2H2O
2NaOH+H2↑+Cl2↑,该反应中NaCl与NaOH完全电离,则该反应的离子反应为
2Cl-+2H2O
2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑.
| ||
故答案为:H:H;
(2)Mg2+和NaOH反应转化为沉淀,离子反应为:Mg2++2OH-═Mg(OH)2↓,
故答案为:Mg2++2OH-═Mg(OH)2↓;
(3)除杂的基本原则是除杂而不引杂,就是不能引入新的杂质.对于该混合物而言,氢氧根离子和氯离子都不是杂质,
而硝酸根离子却是杂质,所以可以选用氢氧化钡,也可以选用氯化钡,但是不能选用硝酸钡,
故答案为:ac;
(4)由于BaSO4比BaCO3的溶解度小,SO42-促使BaCO3(s)?Ba2+(aq)+CO32- (aq)平衡正向移动,生成更难溶的BaSO4沉淀;
故答案为:由于BaSO4比BaCO3的溶解度小,SO42-促使BaCO3(s)?Ba2+(aq)+CO32- (aq)平衡正向移动,生成更难溶的BaSO4沉淀;
(5)氢氧化钠的溶解度随温度的升高而增大,但是氯化钠的溶解度受温度的影响不大,所以氢氧化钠和氯化钠分离的方法是:通过加热蒸发、冷却、结晶、过滤除去NaCl,
故答案为:结晶;过滤;
(6)电解饱和食盐水生成氯气、氢气和氢氧化钠,其反应为2NaCl+2H2O
| ||
2Cl-+2H2O
| ||
| ||
点评:本题考查粗盐提纯及电解原理,明确发生的离子反应及电解反应是解答的关键,注意除杂不能引入新的杂质及试剂的添加顺序,题目难度中等.

练习册系列答案
相关题目
欲配制下列四种含大量阴、阳离子的溶液,其中配不成的是( )
| A、Ca2+、K+、Cl-、CO32- |
| B、K+、Na+、OH-、NO3- |
| C、Mg2+、Ca2+、Cl-、NO3- |
| D、K+、Al3+、SO42-、NO3- |
同分异构现象是造成有机物种类繁多的重要原因之一.下列各组物质中互为同分异构体的是( )
| A、13C与14C |
| B、CH3CH2OH与CH3COOH |
| C、甲烷与丙烷 |
D、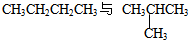 |
下列行为中符合安全要求的是( )
| A、进入煤矿井时,用火把照明 |
| B、用点燃的火柴在液化气钢瓶口检验是否漏气 |
| C、节日期间,在开阔的广场燃放烟花炮竹 |
| D、实验时,将水倒入浓硫酸配制稀硫酸 |