题目内容
(1)Cl元素位于元素周期表的第三周期 族,Cl原子的结构示意图为 .
(2)不能比较硫、氯的非金属性强弱的是 (选填编号).
a.S2-、Cl-的还原性 b.高氯酸和硫酸的酸性
c.H-Cl键和H-S键的稳定性 d.氯化钠和硫化钠溶液的pH
(3)漂粉精可由Cl2通入消石灰中制备,漂粉精的有效成分是 ; 将硝酸银溶液滴入下列物质的溶液中,无明显现象的是 (选填编号).
a.碘化钾 b.氯酸钾 c.氯水 d.盐酸.
(2)不能比较硫、氯的非金属性强弱的是
a.S2-、Cl-的还原性 b.高氯酸和硫酸的酸性
c.H-Cl键和H-S键的稳定性 d.氯化钠和硫化钠溶液的pH
(3)漂粉精可由Cl2通入消石灰中制备,漂粉精的有效成分是
a.碘化钾 b.氯酸钾 c.氯水 d.盐酸.
考点:元素周期表的结构及其应用,元素周期律的作用,氯、溴、碘及其化合物的综合应用
专题:元素周期律与元素周期表专题
分析:(1)Cl的质子数为17,最外层电子数为7,有3个电子层;
(2)利用气态氢化物的稳定性、最高价氧化物的水化物的酸性、阴离子的还原性等比较非金属性;
(3)Cl2通入消石灰中反应生成氯化钙、次氯酸钙,有效成分具有强氧化性;与银离子反应生成沉淀的有明显现象.
(2)利用气态氢化物的稳定性、最高价氧化物的水化物的酸性、阴离子的还原性等比较非金属性;
(3)Cl2通入消石灰中反应生成氯化钙、次氯酸钙,有效成分具有强氧化性;与银离子反应生成沉淀的有明显现象.
解答:
解:(1)Cl的质子数为17,最外层电子数为7,有3个电子层,原子结构示意图为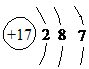 ,位于元素周期表的第三周期第VIIA族,
,位于元素周期表的第三周期第VIIA族,
故答案为:VIIA;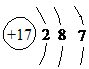 ;
;
(2)a.S2-、Cl-的还原性,则非金属性Cl>S,故a不选;
b.高氯酸和硫酸的酸性,均为最高价氧化物的水化物,可比较非金属性,故b不选;
c.H-Cl键和H-S键的稳定性,可比较非金属性,故不选;
d.氯化钠和硫化钠溶液的pH,可确定HCl酸性强,但不能利用无氧酸的酸性比较非金属性,故选;
故答案为:d;
(3)Cl2通入消石灰中反应生成氯化钙、次氯酸钙,有效成分具有强氧化性,则有效成分为Ca(ClO)2;a与银离子反应生成黄色沉淀,c、d中生成白色沉淀,只有b不反应,没有明显现象,
故答案为:Ca(ClO)2;b.
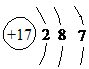 ,位于元素周期表的第三周期第VIIA族,
,位于元素周期表的第三周期第VIIA族,故答案为:VIIA;
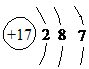 ;
;(2)a.S2-、Cl-的还原性,则非金属性Cl>S,故a不选;
b.高氯酸和硫酸的酸性,均为最高价氧化物的水化物,可比较非金属性,故b不选;
c.H-Cl键和H-S键的稳定性,可比较非金属性,故不选;
d.氯化钠和硫化钠溶液的pH,可确定HCl酸性强,但不能利用无氧酸的酸性比较非金属性,故选;
故答案为:d;
(3)Cl2通入消石灰中反应生成氯化钙、次氯酸钙,有效成分具有强氧化性,则有效成分为Ca(ClO)2;a与银离子反应生成黄色沉淀,c、d中生成白色沉淀,只有b不反应,没有明显现象,
故答案为:Ca(ClO)2;b.
点评:本题考查较综合,涉及元素的位置及原子结构、非金属性比较及漂白粉性质等,把握规律性知识的应用及微粒的性质为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
已知:二氧化氮存在2NO2?N2O4 △H<0平衡.在测定NO2的相对分子质量时,下列条件中测定值最接近46的是( )
| A、温度130℃、压强3.03×105Pa |
| B、温度25℃、压强1.01×105Pa |
| C、温度130℃、压强5.05×104Pa |
| D、温度0℃、压强5.05×104Pa |
下列涉及有机物的说法正确的是( )
| A、乙烯和聚乙烯都能发生加聚反应 |
| B、汽油、煤油、柴油和植物油都是碳氢化合物 |
| C、乙烯、苯都可与溴水发生加成反应 |
| D、2己烯能使KMnO4(H+)溶液褪色 |

 的名称是
的名称是 名称是
名称是
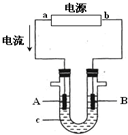 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下 如图1为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图1为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: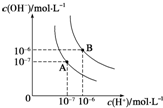 (1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示95℃时水的电离达平衡时的离子浓度.则95℃时0.1mol?L-1的NaOH溶液中,由水电离出的 c(H+)=
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示95℃时水的电离达平衡时的离子浓度.则95℃时0.1mol?L-1的NaOH溶液中,由水电离出的 c(H+)=