题目内容
写出下列物质在水溶液中的变化
(1)NaHSO4的电离 .
(2)H2S的电离 .
(3)NH4Cl的水解离子方程式 .
(4)泡沫灭火器原理的离子方程式 .
(1)NaHSO4的电离
(2)H2S的电离
(3)NH4Cl的水解离子方程式
(4)泡沫灭火器原理的离子方程式
考点:电离方程式的书写,离子方程式的书写
专题:离子反应专题
分析:(1)硫酸氢钠属于强酸强碱盐,在水溶液里完全电离生成钠离子、氢离子和硫酸根离子;
(2)硫化氢属于二元弱酸,在水溶液里部分电离,且硫氢根离子也能电离生成氢离子和硫离子,但第二步电离远远小于第一步;
(3)氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性;
(4)铝离子和碳酸氢根离子发生双水解生成氢氧化铝沉淀和二氧化碳气体.
(2)硫化氢属于二元弱酸,在水溶液里部分电离,且硫氢根离子也能电离生成氢离子和硫离子,但第二步电离远远小于第一步;
(3)氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性;
(4)铝离子和碳酸氢根离子发生双水解生成氢氧化铝沉淀和二氧化碳气体.
解答:
解:(1)硫酸氢钠属于强酸强碱盐,在水溶液里完全电离生成钠离子、氢离子和硫酸根离子,电离方程式为NaHSO4=Na++H++SO42-,故答案为:NaHSO4=Na++H++SO42-;
(2)硫化氢属于二元弱酸,在水溶液里部分电离,且硫氢根离子也能电离生成氢离子和硫离子,但第二步电离远远小于第一步,其电离方程式为H2S?H++HS-、HS-?H++S2-,故答案为:H2S?H++HS-、HS-?H++S2-;
(3)氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,其水解离子方程式为NH4++H20?NH3?H2O+H+,故答案为:NH4++H20?NH3?H2O+H+;
(4)铝离子和碳酸氢根离子发生双水解生成氢氧化铝沉淀和二氧化碳气体,离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(2)硫化氢属于二元弱酸,在水溶液里部分电离,且硫氢根离子也能电离生成氢离子和硫离子,但第二步电离远远小于第一步,其电离方程式为H2S?H++HS-、HS-?H++S2-,故答案为:H2S?H++HS-、HS-?H++S2-;
(3)氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,其水解离子方程式为NH4++H20?NH3?H2O+H+,故答案为:NH4++H20?NH3?H2O+H+;
(4)铝离子和碳酸氢根离子发生双水解生成氢氧化铝沉淀和二氧化碳气体,离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑.
点评:本题考查了电离方程式、水解方程式的书写,根据电解质的强弱及电解质的电离书写电离方程式,注意硫酸氢钠在水溶液里或熔融状态下电离方程式的区别,为易错点.

练习册系列答案
相关题目
下列各组物质中,互为同分异构体的是( )
| A、O2和O3 | ||||
B、
| ||||
| C、CH4和CH3CH3 | ||||
D、 和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
下列说法或表示方法正确的是( )
| A、反应物总能量低于生成物总能量时,该反应不能发生 |
| B、稀的强酸与稀的强碱反应放出的热量就是中和热 |
| C、由C(石墨)(s)→C(金刚石)(s);△H>0可行,石墨比金刚石稳定 |
| D、在101kPa,25℃时,2gH2完全燃烧生成液态水,放出285.8kJ的热量;氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(1);△H=-285.8kJ/mol |

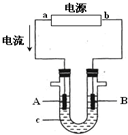 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下 如图1为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图1为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: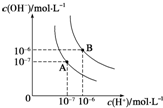 (1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示95℃时水的电离达平衡时的离子浓度.则95℃时0.1mol?L-1的NaOH溶液中,由水电离出的 c(H+)=
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示95℃时水的电离达平衡时的离子浓度.则95℃时0.1mol?L-1的NaOH溶液中,由水电离出的 c(H+)=