题目内容
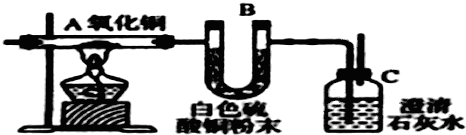
 某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图.材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物.如:2NH3+3CuO
某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图.材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物.如:2NH3+3CuO
| ||
材料2:Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu,Cu2O+2H+═Cu2++Cu+H2O
请回答下列问题:
(1)在实验室里,该学习小组设计下列制取纯净干燥氨气的方案,简易、可行的最佳方案是
A.加热氯化氨固体,再通过碱石灰
B.在N2和H2的混合气体中加入铁触媒,并加热至500℃,再通过碱石灰
C.加热浓氨水,再通过碱石灰
D.在生石灰中加入浓氨水,再通过碱石灰
(2)为证明NH3 还原CuO的反应中有水生成,B中应放入的试剂是
(3)当观察到
(4)该小组欲用体积比为1:4的稀硫酸做试剂,检验反应是否有Cu2O固体生成.现用98%的浓硫酸配制1:4的稀硫酸,所需的玻璃仪器除了胶头滴管外还有
(5)请写出A中生成Cu2O的化学方程式
(6)若用定量的方法测定该反应是否生成Cu2O,最简便且准确的方法是
考点:性质实验方案的设计,氨的化学性质
专题:实验设计题
分析:(1)A.加热氯化氨固体,生成的氨气和氯化氢在冷却时又生成氯化铵;
B.N2和H2在一定条件下合成氨气是可逆反应,故生成的氨气中有N2和H2;
C.加热浓氨水分解生成氨气,再通过碱石灰除去少量的水蒸气;
D.在生石灰中加入浓氨水,利用生石灰与水反应放热使氨水分解,但没有C直接加热效果好;
(2)检验反应中有无水生成,应该用无水硫酸铜;
(3)当氧化铜(黑色)完全转变为铜单质(红色)的时候,反应完全;
(4)根据仪器的作用选取仪器;氧化亚铜和稀硫酸反应生成硫酸铜和铜单质,如果将固体加入稀硫酸中有红色物质生成,就说明含有氧化亚铜;
(5)根据氧化还原反应的特征结合反应物氨气和氧化铜反应生成Cu2O书写方程式;
(6)若用定量的方法测定该反应是否生成Cu2O,如果没有就只生成铜单质,所以可以称量反应前后装置A中固体的质量来判断;
B.N2和H2在一定条件下合成氨气是可逆反应,故生成的氨气中有N2和H2;
C.加热浓氨水分解生成氨气,再通过碱石灰除去少量的水蒸气;
D.在生石灰中加入浓氨水,利用生石灰与水反应放热使氨水分解,但没有C直接加热效果好;
(2)检验反应中有无水生成,应该用无水硫酸铜;
(3)当氧化铜(黑色)完全转变为铜单质(红色)的时候,反应完全;
(4)根据仪器的作用选取仪器;氧化亚铜和稀硫酸反应生成硫酸铜和铜单质,如果将固体加入稀硫酸中有红色物质生成,就说明含有氧化亚铜;
(5)根据氧化还原反应的特征结合反应物氨气和氧化铜反应生成Cu2O书写方程式;
(6)若用定量的方法测定该反应是否生成Cu2O,如果没有就只生成铜单质,所以可以称量反应前后装置A中固体的质量来判断;
解答:
解:(1)A.加热氯化氨固体,生成的氨气和氯化氢在冷却时又生成氯化铵,故A错误;
B.N2和H2在一定条件下合成氨气是可逆反应,故生成的氨气中有N2和H2,故B错误
C.加热浓氨水分解生成氨气,再通过碱石灰除去少量的水蒸气,故可制取纯净干燥氨气,故C正确;
D.在生石灰中加入浓氨水,利用生石灰与水反应放热使氨水分解,一般不用再干燥即可得到干燥的氨气,故D错误;
故选:C;
(2)检验反应中有无水生成,应该用无水硫酸铜,当无水硫酸铜遇水时立即生成蓝色的硫酸铜晶体,故答案为:无水硫酸铜;
(3)当氧化铜(黑色)完全转变为铜单质(红色)的时候,反应完全,故答案为:A中固体由黑色完全变为红色;
(4)配制硫酸时,需要烧杯盛放硫酸溶液,需要量筒、滴定管量取浓硫酸,稀释时并用玻璃棒不断搅拌,所以还需要烧杯、量筒、玻璃棒;氧化亚铜和稀硫酸反应生成CuSO4和Cu,将固体加入稀硫酸中,如果有红色物质生成,就说明含有氧化亚铜,否则没有氧化亚铜,其检验方法为:取少许样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有,故答案为:烧杯、量筒、玻璃棒;取少许样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有;
(5)根据氧化还原反应的特征,A中生成Cu2O的化学方程式为:2NH3+6CuO
3Cu2O+N2+3H2O,故答案为:2NH3+6CuO
3Cu2O+N2+3H2O;
(6)若用定量的方法测定该反应是否生成Cu2O,如果没有就只生成铜单质,所以可以称量反应前后装置A中固体的质量来判断,故答案为:称量反应前后装置A中固体的质量;
B.N2和H2在一定条件下合成氨气是可逆反应,故生成的氨气中有N2和H2,故B错误
C.加热浓氨水分解生成氨气,再通过碱石灰除去少量的水蒸气,故可制取纯净干燥氨气,故C正确;
D.在生石灰中加入浓氨水,利用生石灰与水反应放热使氨水分解,一般不用再干燥即可得到干燥的氨气,故D错误;
故选:C;
(2)检验反应中有无水生成,应该用无水硫酸铜,当无水硫酸铜遇水时立即生成蓝色的硫酸铜晶体,故答案为:无水硫酸铜;
(3)当氧化铜(黑色)完全转变为铜单质(红色)的时候,反应完全,故答案为:A中固体由黑色完全变为红色;
(4)配制硫酸时,需要烧杯盛放硫酸溶液,需要量筒、滴定管量取浓硫酸,稀释时并用玻璃棒不断搅拌,所以还需要烧杯、量筒、玻璃棒;氧化亚铜和稀硫酸反应生成CuSO4和Cu,将固体加入稀硫酸中,如果有红色物质生成,就说明含有氧化亚铜,否则没有氧化亚铜,其检验方法为:取少许样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有,故答案为:烧杯、量筒、玻璃棒;取少许样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有;
(5)根据氧化还原反应的特征,A中生成Cu2O的化学方程式为:2NH3+6CuO
| ||
| ||
(6)若用定量的方法测定该反应是否生成Cu2O,如果没有就只生成铜单质,所以可以称量反应前后装置A中固体的质量来判断,故答案为:称量反应前后装置A中固体的质量;
点评:本题以氨气的制备为载体考查了氨气还原氧化铜的产物的测定,涉及物质的检验、仪器的选取、物质间的反应等知识点,明确物质的性质是解本题关键,题目难度中等.

练习册系列答案
相关题目
在298K时,NaCl 在水中的溶解度为
水.如将1molNaCl溶解在1L水中,此溶解过程中体系的△H-T△S和熵如何变化( )
| 26g |
| 100g |
| A、△H-T△S<0△S<0 |
| B、△H-T△S<0△S>0 |
| C、△H-T△S>0△S>0 |
| D、△H-T△S>0△S<0 |
将氯化钠、乙醇、碘分别从以下三组混合物中分离出来:①氯化钠和水 ②乙醇和水 ③碘和水,宜采取的操作方法依次是( )
| A、蒸发、蒸馏、萃取 |
| B、萃取、蒸馏、蒸发 |
| C、蒸发、萃取、蒸馏 |
| D、蒸馏、萃取、蒸发 |
某无色透明的溶液,能使石蕊变红,也能使酚酞变红的溶液中都能大量共存的是( )
| A、Fe3+ K+ SO42- NO3- |
| B、Mg2+NH4+ SO42- Cl- |
| C、Na+ K+ SO42- NO3- |
| D、K+ Na+ MnO4- SO42- |
 A、B、C、D、E、F、G、H是相对分子质量依次增大的气体,它们均由短周期元素组成,具有如下性质:
A、B、C、D、E、F、G、H是相对分子质量依次增大的气体,它们均由短周期元素组成,具有如下性质: