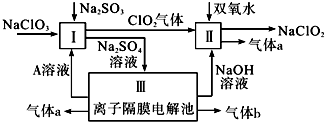
��Ŀ����
4��300��ʱ����2mol A��2mol B������������2L�ܱ������У��������·�Ӧ��3A��g��+B��g��?2C��g��+2D��g����H��2minĩ�ﵽƽ�⣬����0.8mol D����1����2minĩʱ��A��ƽ��Ũ��Ϊ0.4mol/L��B��ת����20%��0-2min��D��ƽ����Ӧ����Ϊ0.2mol/��L•min����
��2���÷�Ӧ��ƽ�ⳣ������ʽΪ��K=$\frac{c{\;}^{2}��C����c{\;}^{2}��D��}{c{\;}^{3}��A����c��B��}$�����¶��µĻ�ѧƽ�ⳣ����ֵΪK10.5����֪350��ʱK2=l�����H��0���������������
��3����300��ʱ�����÷�Ӧ����ѹ�����ΪlL����A��ת���ʲ��䣨���������С�����䡱����ԭ���Ƿ�Ӧǰ������������䣬ѹǿ��ƽ����Ӱ�죮
���� ��������ʽ�������ֵ����ʵ����ı仯����ƽ��ʱ����ֵ����ʵ�����
��1�����ݷ���ʽ����A�����ʵ����ɼ���A��Ũ�ȣ�����ת����=$\frac{��ת�������ʵ���}{��ʼ���ʵ���}$��100%���㣬����v=$\frac{��c}{��t}$���㷴Ӧ���ʣ�
��2����ѧƽ�ⳣ�������������Ũ����֮�����Է�Ӧ���Ũ����֮��������ƽ�ⳣ���ı仯���ж��¶ȶ�ƽ���ƶ���Ӱ�죻
��3���÷�Ӧ��Ӧǰ������������䣬����ѹǿƽ�ⲻ�ƶ����ݴ��ж�A��ת���ʣ�
��� �⣺���ڷ�Ӧ 3A��g��+B��g�� 2C��g��+2D��g����
2C��g��+2D��g����
��ʼ��mol����2 2 0 0
�仯��mol����1.2 0.4 0.8 0.8
ƽ�⣨mol����0.8 1.6 0.8 0.8
��1�������������֪��ƽ��ʱA�����ʵ���Ϊ0.8mol������B��ƽ��Ũ��Ϊc��A��=$\frac{0.8mol}{2L}$=0.4mol/L��
B��ת����Ϊ$\frac{0.4mol}{2mol}$��100=20%��
ƽ��ʱD�����ʵ���Ϊ0.8mol��������D��ʾ��ƽ����Ӧ����Ϊv��D��=$\frac{\frac{0.8mol}{2L}}{2min}$=0.2mol/��L•min����
�ʴ�Ϊ��0.4mol/L��20%��0.2mol/��L•min����
��2����ѧƽ�ⳣ�������������Ũ����֮�����Է�Ӧ���Ũ����֮������K1=$\frac{c{\;}^{2}��C����c{\;}^{2}��D��}{c{\;}^{3}��A����c��B��}$=$\frac{��\frac{0.8mol}{2L}��^{2}•��\frac{0.8mol}{2L}��^{2}}{��{\frac{0.8mol}{2L}��}^{3}•��\frac{1.6mol}{2L}��}$=0.5��K2=l������K300����K350����˵�������¶�ƽ��������Ӧ�����ƶ���������Ӧ���ȣ���H��0��
�ʴ�Ϊ��$\frac{c{\;}^{2}��C����c{\;}^{2}��D��}{c{\;}^{3}��A����c��B��}$��0.5������
��3���ɷ���ʽ��֪������Ļ�ѧ������֮��ǰ����ȣ���Ӧǰ������������䣬ѹǿ��ƽ����Ӱ�죬��С�����ݻ�����A��ת���ʲ��䣬
�ʴ�Ϊ�����䣻��Ӧǰ������������䣬ѹǿ��ƽ����Ӱ�죮
���� ���⿼�鷴Ӧ���ʵļ��㡢��Чƽ��ȣ��Ѷ��еȣ�ע������ʽ���ⷨ�����ã�ע����յ�Чƽ��������Ӧ�ã�

| A�� | V��NO2����V��O2��=2��1 | B�� | V��NO����V��O2��=2��1 | ||
| C�� | V��NH3����V��O2��=2��1 | D�� | V��NO2����V��NO����V��O2��=1��1��1 |
| A�� | Na+��Cu2+��NO${\;}_{3}^{-}$��SO${\;}_{4}^{2-}$ | B�� | H+��K+��HCO${\;}_{3}^{-}$��Ca2+ | ||
| C�� | Ba2+��Mg2+��OH-��Cl- | D�� | Fe3+��NH${\;}_{4}^{+}$��S2-��Cl- |

���н�����ȷ���ǣ�������
| A�� | X�в���ȷ����������Fe3+��A13+��K+��Na+��C1- | |
| B�� | ����G�м��������ܽ⣬�μ�KSCN��Һ�Ժ�ɫ������ȷ��ԭ��Һ����Fe3+ | |
| C�� | ��ҺJ��ɫ��Ӧ�Ի�ɫ����˵��ԭ��Һ�д���Na+ | |
| D�� | ����Iһ����A1��OH��3 |
| ���ữѧʽ | CH3COOH | HCLO | H2CO3 |
| ����ƽ�ⳣ����25�棩 | 1.75��10-5 | 3.0��10-8 | K1=4.4��10-7 K2=4.7��10-11 |
��1�����ʵ���Ũ��Ϊ0.1mol•L-1������ 4 �����ʣ�pH ������A��
A��NaCO3 B��NaCLO C��CH3COONa D��NaHCO3
��2����������ˮ�д������Ũ�ȣ���������ˮ�м����������A��
A��Na2CO3 B��NaCLO C��CH3COONa D��NaHCO3
��3��������0.1mol•L-1��CH3COOH ��Һ��ˮϡ���̣����б���ʽ������һ����С����
A��
A��c��H+�� B.$\frac{c��{H}^{+}��}{c��C{H}_{3}COOH��}$ C��c��H+��c��OH-�� D.$\frac{c��O{H}^{-}��}{c��{H}^{+}��}$
��4�����Ϊ10mLpH=2 �Ĵ�����Һ��һԪ��HX �ֱ��ˮϡ����1000mL��ϡ����pH ��
������ͼ��ʾ����HX �����Դ��ڣ�����ڡ������ڡ���С�ڡ�����������ԣ�ϡ�ͺ�
HX ��Һ��ˮ���������c��H+�����ڴ�����Һˮ�������c��H+��������ڡ������ڡ���С�ڡ�����
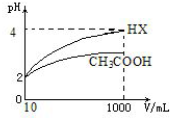
��5��25��ʱ��CH3COOH��CH3COONa�Ļ����Һ������û��ҺpH=6������Һ��
?c��CH3COO-��-c��Na+��=1.0��10-6-1.0��10-8mol/L������ȷ��ֵ��
| A�� |  �Ʊ��������� | B�� |  �������ճɻ� | ||
| C�� |  ��Һʱȡ���²�Һ�� | D�� |  ��������� |
| A�� | ����ͬ�������£����ױȺ����ȶ� | |
| B�� | ������������ȼ�������� | |
| C�� | ���Ͱ��Ľṹ��ͬ | |
| D�� | ������ͬ�������£����ױȰ����ȶ� |