题目内容
15.根据如图信息完成所需回答的问题: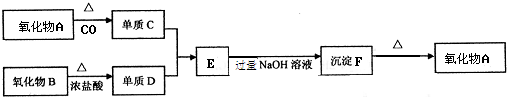
其中氧化物B是黑色固体;单质C不溶于冷浓硫酸.
(1)E是FeCl3(填化学式).
(2)写出氧化物A和CO反应的化学方程式Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2 .
(3)写出B和浓盐酸反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
分析 单质C不溶于冷浓硫酸,可为Fe或Al,C可由氧化物A和CO反应生成,则C只能为Fe,黑色氧化物和与浓盐酸在加热条件下反应生成单质D,则可知B为MnO2,D为Cl2,由转化关系可知E为FeCl3,F为Fe(OH)3,分解生成的A为Fe2O3,以此解答该题.
解答 解:单质C不溶于冷浓硫酸,可为Fe或Al,C可由氧化物A和CO反应生成,则C只能为Fe,黑色氧化物和与浓盐酸在加热条件下反应生成单质D,则可知B为MnO2,D为Cl2,由转化关系可知E为FeCl3,F为Fe(OH)3,分解生成的A为Fe2O3,
(1)由以上分析可知E为FeCl3,故答案为:FeCl3;
(2)由以上分析可知氧化物A和CO反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2,故答案为:Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2;
(3)加热条件下,二氧化锰和浓盐酸发生氧化还原反应生成氯气,反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
点评 本题考查无机物推断,为高频考点,明确物质特殊性质、物质之间特殊反应是解本题关键,注意铁的性质以及铝热反应,题目难度不大.

练习册系列答案
相关题目
5. 白磷分子的结构如图所示,小球表示磷原子,实线表示共价键,白磷分子中的每个P-P键之间插入一个氧原子后得化合物A,下列关于该化合物A的说法正确的是( )
白磷分子的结构如图所示,小球表示磷原子,实线表示共价键,白磷分子中的每个P-P键之间插入一个氧原子后得化合物A,下列关于该化合物A的说法正确的是( )
 白磷分子的结构如图所示,小球表示磷原子,实线表示共价键,白磷分子中的每个P-P键之间插入一个氧原子后得化合物A,下列关于该化合物A的说法正确的是( )
白磷分子的结构如图所示,小球表示磷原子,实线表示共价键,白磷分子中的每个P-P键之间插入一个氧原子后得化合物A,下列关于该化合物A的说法正确的是( )| A. | 化合物A的分子式为P2O3 | |
| B. | 化合物A是磷酸的酸酐 | |
| C. | 化合物A是磷元素的最高价氧化物 | |
| D. | 化合物A中每个原子最外层都达到8电子的稳定结构 |
3.下列说法正确的是( )
| A. | N2分子中有一个σ键,2个π键 | |
| B. | 气体单质中,一定有σ键,可能有π键 | |
| C. | 通常,π键比σ键电子云重叠程度大,形成的共价键更牢固 | |
| D. | 两个原子间形成共价键时,σ键的数目取决于未成对电子的数目 |
10.在室温度下,在密闭容器中某气态烃和氧气按一定比例混合,点火爆炸后恢复到室温度,压强减小至原来的一半,若加入NaOH溶液则气体被全部吸收,则此烃为( )
| A. | C2H2 | B. | C2H4 | C. | C2H6 | D. | C6H6 |
20.下列说法中正确的是( )
| A. | 升高温度,可使单位体积内活化分子数增多,反应速率加快 | |
| B. | 已知:C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3 kJ/mol,△S=+133.7 kJ/mol则该反应在低温下能自发进行 | |
| C. | 将FeCl3的水溶液加热蒸干可得到FeCl3固体 | |
| D. | 使用催化剂可降低反应的△H和反应的活化能,从而提高化学反应速率 |
7.过氧乙酸(CH3COOOH)有强氧化性,用于物体表面、皮肤、果蔬、环境的消毒,其制备反应为:CH3COOH+H2O2?CH3COOOH+H2O,下列有关说法正确的是( )
| A. | 降低温度可加快该反应速率 | |
| B. | 加入合适的催化剂可提高H2O2转化率 | |
| C. | 达到平衡时,v(正)=v(逆)=0 | |
| D. | 达到平衡时,v正(CH3COOH)=v逆(H2O2) |
5.下列化合物在核磁共振氢谱中能出现两组峰.且其峰面积之比为3:1的有( )
| A. | 乙酸乙酯 | B. | 乙酸异丙酯 | C. | 均三甲苯 | D. | 对二甲苯 |
