题目内容
2.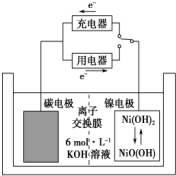 一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法中不正确的是( )
一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法中不正确的是( )| A. | 充电时阴极反应:2H2O+2e-═2OH-+H2↑ | |
| B. | 充电时将碳电极与电源的负极相连 | |
| C. | 放电时,OH-移向碳电极 | |
| D. | 放电时镍电极反应为:Ni(OH)2+OH--e-═NiO(OH)+H2O |
分析 根据图片中电子流向知,放电时,石墨电极是负极,电极反应式为H2+2OH--2e-=2H2O,正极反应式为NiO(OH)+H2O+e-═Ni(OH)2+OH-,充电时阴阳极与放电时负极、正极反应式正好相反,以此解答该题.
解答 解:A.放电时,电解质溶液呈碱性,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为H2+2OH--2e-=2H2O,充电与放电相反,阴极反应:2H2O+2e-═2OH-+H2↑,故A正确;
B.充电时,C电极作阴极,所以应该与电源负极相连,故B正确;
C.放电时阴离子向负极移动,即向碳电极移动,故C正确;
D.放电时镍电极是正极,正极上NiO(OH)得电子发生还原反应生成Ni(OH)2,电极反应式为NiO(OH)+H2O+e-═Ni(OH)2+OH-,故D错误;
故选D.
点评 本题考查化学电源新型电池,为高考高频点,明确各个电极上发生的反应是解本题关键,会结合电解质溶液酸碱性书写电极反应式,知道放电时和充电时电极反应式关系,题目难度中等.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
12.下列关于硅及其化合物的说法正确的是( )
| A. | 硅是光导纤维的主要成分 | |
| B. | 硅钨酸H4SiW12O40中W的化合价为+6 | |
| C. | 二氧化硅与水反应制得的硅酸溶胶有丁达尔效应 | |
| D. | 硅是非金属元素,合金材料中不可能含有硅 |
13.把200mL 有BaCl2和KCl 的混合溶液分成2 等份,取一份加入含a mol 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
| A. | 5(b-2a) mol/L | B. | 10(2a-b) mol/L | C. | 10(b-a) mol/L | D. | 10(b-2a) mol/L |
10.在室温度下,在密闭容器中某气态烃和氧气按一定比例混合,点火爆炸后恢复到室温度,压强减小至原来的一半,若加入NaOH溶液则气体被全部吸收,则此烃为( )
| A. | C2H2 | B. | C2H4 | C. | C2H6 | D. | C6H6 |
7.过氧乙酸(CH3COOOH)有强氧化性,用于物体表面、皮肤、果蔬、环境的消毒,其制备反应为:CH3COOH+H2O2?CH3COOOH+H2O,下列有关说法正确的是( )
| A. | 降低温度可加快该反应速率 | |
| B. | 加入合适的催化剂可提高H2O2转化率 | |
| C. | 达到平衡时,v(正)=v(逆)=0 | |
| D. | 达到平衡时,v正(CH3COOH)=v逆(H2O2) |
14.同温同压下,两种气体的体积如果不相同,其主要原因是( )
| A. | 气体的分子大小不同 | B. | 气体的物质的量不同 | ||
| C. | 气体的性质不同 | D. | 气体的分子间距离不同 |
11.已知合成氨反应的浓度数据如下:3H2+N2?$?_{高温高压}^{催化剂}$ 2NH3
则用NH3的浓度的增加来表示该反应的反应速率为( )
| 起始浓度/mol•L-1 | 3 | 1 | 0 |
| 2s末浓度/mol•L-1 | 1.8 | 0.6 | 0.8 |
| A. | 0.4 mol•L-1•s-1 | B. | 0.2 mol•L-1•s-1 | C. | 0.8 mol•L-1•s-1 | D. | 0.6 mol•L-1•s-1 |