题目内容
17.下列表述正确的是( )| A. | S2-的结构示意图: | B. | 碳原子电子式为  | ||
| C. | 氟化钠的电子式: | D. | 氨气分子的结构式: |
分析 A.硫离子的核电荷数为16,不是18;
B.碳原子最外层含有4个电子;
C.氟化钠为离子化合物,阴阳离子需要标出所带电荷,氟离子还需要标出最外层电子;
D.结构式中不需要标出未成键电子对.
解答 解:A.S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,硫离子结构示意图为 ,故A错误;
,故A错误;
B.C原子最外层含有4个电子,其正确的电子式为 ,故B错误;
,故B错误;
C.氟化钠为离子化合物,钠离子直接用离子符号表示,氟离子需要标出所带电荷及最外层电子,其电子式为 ,故C正确;
,故C正确;
D.氨气分子的结构式为: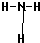 ,结构式中不能标出孤电子对,故D错误;
,结构式中不能标出孤电子对,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,涉及电子式、结构式、离子结构示意图等知识,明确常见化学用语的概念及书写原则为解答关键,试题侧重考查学生的分析能力及规范答题能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列图象分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )
| A. | 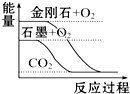 石墨转变为金刚石是吸热反应 | |
| B. | 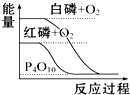 白磷比红磷稳定 | |
| C. | 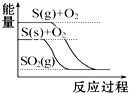 S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2 则△H1>△H2 | |
| D. | 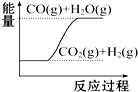 CO(g)+H2O(g)═CO2(g)+H2(g)△H1>0 |
8.假设某化学反应的反应过程如下图所示观察分析,符合图中变化的化学反应为( )


| A. | A2+3B2?2AB3 | B. | 2AB2+B2?2AB3 | C. | 2A2 B+5B2═4AB3 | D. | 2AB2+B2═2AB |
5.下列化合物的核磁共振氢谱中出现两组峰且峰面积之比是2:1的是( )
| A. | 乙酸甲酯 | B. | 对苯二酚 | C. | 2--甲基丙烷 | D. | 对二甲苯 |
12.下列对卤素性质的说法不符合递变规律的是( )
| A. | F2、Cl2、Br2、I2的氧化性逐渐减弱 | |
| B. | HF、HCl、HBr、HI的热稳定性逐渐减弱 | |
| C. | F-、Cl-、Br-、I-的还原性逐渐增强 | |
| D. | 卤素单质按F2、Cl2、Br2、I2的顺序颜色变浅,密度增大 |
6.一定条件下,某容器中各微粒在反应前后变化的示意图如图所示,其中●和○代表不同元素的原子.关于此反应判断错误的是( )


| A. | 可能是双氧水分解反应 | |
| B. | 充分反应后,还有 物质,则属于可逆反应 物质,则属于可逆反应 | |
| C. | 反应前后,一定是共价键的断裂与生成 | |
| D. | 反应方程式可表示为2 =2 =2 + + |
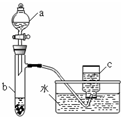 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.