题目内容
20.(1)已知C(石墨,s)?c(金刚石,s),△H>0,则稳定性:金刚石<石墨(填“>”或“<”)(2)已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1 <△H2(填“>”或“<”).
(3)“嫦娥五号”预计在海南文昌发射中心发射,火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备.用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水.已知:N2(g)+2O2(g)═N2O4(g)△H=+10.7kJ•mol-1 N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-543 kJ•mol-1写出气态肼和N2O4反应的热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1096.7KJ/mol.
(4)25℃,101kPa时,14gCO在足量的O2中充分燃烧,放出141.3 kJ的热,则CO的燃烧热为△H=-282.6kJ•mol-1.
(5)0.50L 2.00mol/L H2SO4溶液与2.10L 1.00mol/L KOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为△H=-57.3kJ/mol.
(6)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式是N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.
分析 (1)物质的能量越高,该物质越不稳定;
(2)C的燃烧为放热反应,完全燃烧放出较多能量;
(3)依据热化学方程式和盖斯定律计算得到,a、N2(g)+2O2(g)=N2O4(g)△H=10.7kJ•mol-1;b、N2H4(g)+O2 (g)=N2(g)+2H2O(g)△H=-543kJ•mol-1,由盖斯定律b×2-a得到;
(4)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,计算1molCO完全燃烧放出的热量,结合热化学方程式的书写方法写出热化学方程式;
(5)根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热以及中和热的热化学方程式;
(6)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
解答 解:(1)物质的能量越高,该物质越不稳定,C(s.石墨)═C(s.金刚石)△H>0,石墨的能量小于金刚石,所以稳定性石墨>金刚石,故答案为:<;
(2)C的燃烧为放热反应,则△H<0,完全燃烧放出较多能量,放出的能量越多△H越小,则△H1<△H2,故答案为:<;
(3)a、N2(g)+2O2(g)=N2O4(g)△H=10.7kJ•mol-1;b、N2H4(g)+O2 (g)=N2(g)+2H2O(g)△H=-543kJ•mol-1
由盖斯定律b×2-a得到 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1096.7KJ/mol,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1096.7KJ/mol;
(4)1molCO为28g,14gCO在足量的O2中充分燃烧,放出141.3 kJ的热,则1molCO完全燃烧放出282.6kJ热量,CO的燃烧热为△H=-282.6kJ•mol-1,
故答案为:-282.6kJ•mol-1;
(5)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为-11.46kJ/mol,中和热为-57.3kJ/mol,故答案为:-57.3kJ/mol;
(6)解:在反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,即N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.
点评 本题考查了反应热的计算、热化学方程式和盖斯定律计算应用,为高频考点,侧重考查学生的分析、计算能力的考查,注意把握反应热的计算方法、热化学方程式的书写方法以及盖斯定律的含义,题目难度中等.

| A. | B的单质在自然界只有一种核素 | |
| B. | 元素C、D、E的简单离子的半径依次减小 | |
| C. | A、E分别与C形成的化合物中含有一种相同类型的化学键 | |
| D. | 这几种元素可能形成的简单离子中E的简单离子的还原性最强 |
| A. | 碳酸钠溶液呈碱性,可用于洗去铁屑表面的油污 | |
| B. | 铝易发生钝化,可用于作飞机、火箭的结构材料 | |
| C. | 炭具有还原性,可用于冶炼钠、镁、铝等金属 | |
| D. | 浓硫酸具有强氧化性,可用于干燥二氧化硫气体 |
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭. |
(1)实验目的:研究同周期元素性质递变规律.
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液,酚酞溶液等.
仪器:①试管,②酒精灯,③烧杯,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等.
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①③的化学方程式及此实验的结论)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
此实验的结论:从左到右,同周期元素原子的失电子能力递减,得电子能力递增.
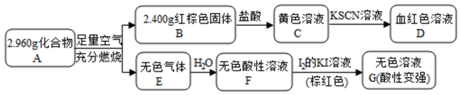
 . 该反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑.
. 该反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑. 如图是一个电化学过程的示意图,请按要求回答下列问题
如图是一个电化学过程的示意图,请按要求回答下列问题
