题目内容
气体中有下列平衡:N2O4(g)?2NO2(g).在27℃,105 Pa条件下气体混合物的平均分子量为76.7.求N2O4分解率.
考点:化学平衡的计算
专题:化学平衡专题
分析:依据化学平衡三段式列式计算
设四氧化二氮起始量为1mol,分解率为x
N2O4 (g)?2NO2 (g)
起始量 1 0
变化量 x 2x
变化量 1-x 2x
混合气体中总物质的量为1+x
据此计算;
设四氧化二氮起始量为1mol,分解率为x
N2O4 (g)?2NO2 (g)
起始量 1 0
变化量 x 2x
变化量 1-x 2x
混合气体中总物质的量为1+x
据此计算;
解答:
解:设四氧化二氮起始量为1mol,分解率为x
N2O4 (g)?2NO2 (g)
起始量 1 0
变化量 x 2x
变化量 1-x 2x
混合气体中总物质的量为1+x
×92.0+
×46.0=76.7
则解得 x=0.20;
N2O4分解率为20%;
答:N2O4分解率为20%;
N2O4 (g)?2NO2 (g)
起始量 1 0
变化量 x 2x
变化量 1-x 2x
混合气体中总物质的量为1+x
| 1-x |
| 1+x |
| 2x |
| 1+x |
则解得 x=0.20;
N2O4分解率为20%;
答:N2O4分解率为20%;
点评:本题考查了化学平衡计算的分析应用,主要是数值处理方法的分析,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
向恒温、恒容(2L)的密闭容器中充入2mol SO2和一定量的O2,发生反应:2SO2(g)+O2(g)
2SO3(g)△H=-197.74kJ?mol-1,4min后达到平衡,这时c(SO2)=0.2mol?L-1,且SO2和O2的转化率相等.下列说法中,不正确的是( )
| 一定条件 |
| A、2 min时,c(SO2)=0.6 mol?L-1 |
| B、用O2表示4 min内的反应速率为0.1 mol?(L?min)-1 |
| C、再向容器中充入1 mol SO3,达到新平衡,n(SO2):n(O2)=2:1 |
| D、4 min后,若升高温度,平衡向逆方向移动,平衡常数K减小 |
下列实验操作能达到预期目的是( )
| A、向某无色溶液中加入BaCl2溶液产生不溶于稀HNO3的白色沉淀,说明原溶液中一定有SO42- |
| B、向某无色溶液中加入盐酸,有无色无味的气体产生,则说明原溶液中一定有CO32- |
| C、向某溶液中滴加KSCN溶液,溶液不变红,再滴加氯水,变红,说明原溶液一定有Fe2+ |
| D、将某溶液进行焰色反应时,火焰呈黄色,则溶液中一定无K+ |
在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液.观察到的现象是先出现黄色沉淀.最终出现黑色沉淀.已知有关物质的溶度积Ksp(25℃)如下:下列叙述错误的是( )
| AgCl | AgI | Ag2S | |
| Ksp | 1.8×10-10 | 8.51×10-16 | 6.3×10-50 |
| A、沉淀转化的实质就是沉淀溶解平衡的移动 |
| B、溶解度小的沉淀可以转化为溶解度更小的沉淀 |
| C、AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同 |
| D、25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同 |
在一定温度下,可逆反应达到平衡时,生成物平衡浓度的系数次方的乘积与反应物平衡浓度的系数次方的乘积之比是一个常数,该常数就叫做化学平衡常数,用符号K表示.在一定温度下的密闭容器中存在如下反应:2SO2(g)+O2(g)
2SO3(g),已知c(SO2)始=0.4mol?L-1,c(O2)始=1mol?L-1经测定该反应在该温度下的平衡常数K=19,则此反应中SO2的转化量为( )
| 催化剂 |
| △ |
| A、0.24 mol?L-1 |
| B、0.28 mol?L-1 |
| C、0.32 mol?L-1 |
| D、0.26 mol?L-1 |
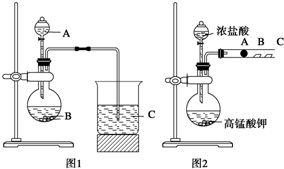 某研究性学习小组设计了一组实验来探究元素周期律.甲同学:根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;
某研究性学习小组设计了一组实验来探究元素周期律.甲同学:根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;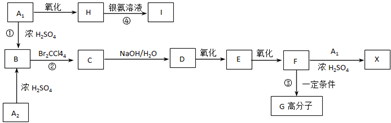
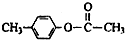 、
、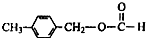 外,其余的结构简式:
外,其余的结构简式: