题目内容
0.1 摩尔MnO2与过量HCl反应,产生标准状态下的氯气多少升?其中被氧化的HCl为多少摩尔?
考点:化学方程式的有关计算
专题:计算题
分析:发生反应:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,根据方程式计算氯气的物质的量,再根据V=nVm计算氯气的体积;根据氯元素化合价变化可知,被氧化的HCl生成氯气,根据氯原子守恒计算被氧化的HCl物质的量.
| ||
解答:
解:设0.1mol二氧化锰完全反应生成氯气的物质的量为x mol,则:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
1 1
0.1mol x mol
1:1=0.1mol:x mol
解得x=0.1mol
故生成氯气的体积=0.1mol×22.4L/mol=2.24L,
根据氯元素化合价变化可知,被氧化的HCl生成氯气,根据氯原子守恒,被氧化的HCl的物质的量=2n(Cl2)=2×0.1mol=0.2mol,
答:标况下生成氯气的体积为2.24L;被氧化的HCl的物质的量是0.2mol.
MnO2+4HCl(浓)
| ||
1 1
0.1mol x mol
1:1=0.1mol:x mol
解得x=0.1mol
故生成氯气的体积=0.1mol×22.4L/mol=2.24L,
根据氯元素化合价变化可知,被氧化的HCl生成氯气,根据氯原子守恒,被氧化的HCl的物质的量=2n(Cl2)=2×0.1mol=0.2mol,
答:标况下生成氯气的体积为2.24L;被氧化的HCl的物质的量是0.2mol.
点评:本题考查化学反应方程式的计算、氧化还原反应计算,比较基础,注意对基础知识的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
欲除去CO2气体中混有的SO2气体,不可以使用的试剂是( )
| A、酸性高锰酸钾溶液 |
| B、饱和碳酸氢钠溶液 |
| C、溴水 |
| D、饱和碳酸钠溶液 |
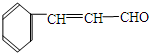 成分,由该物质制取分子式为C16H14O2的酯,过程如下(其他试剂、产物及反应条件均省略):
成分,由该物质制取分子式为C16H14O2的酯,过程如下(其他试剂、产物及反应条件均省略):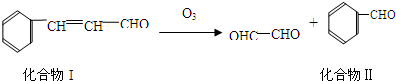

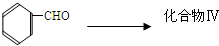
 (1)已知2Cu(s)+
(1)已知2Cu(s)+