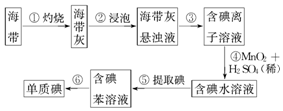
题目内容
8.将0.5mol NaCl固体溶解于水,制得NaCl的物质的量浓度为2mol/L溶液,则溶液的体积为( )| A. | 100 mL | B. | 250 mL | C. | 400 mL | D. | 1000 mL |
分析 根据V=$\frac{n}{c}$计算氯化钠溶液的体积.
解答 解:V(NaCl)=$\frac{n}{c}$=$\frac{0.5mol}{2mol/L}$=0.25L=250mL,故选B.
点评 本题考查物质的量浓度的计算,为高频考点,侧重考查学生计算能力,明确各个物理量之间的关系是解本题关键,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
18.下列说法中不正确的是( )
| A. | 常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存 | |
| B. | 在含有0.1mol•L-1 Fe3+的溶液中:SCN-、Cl-、K+不能大量共存 | |
| C. | 在含有HCO3-、SO32-、S2-、CH3COO-四种阴离子的溶液中加入足量的Na2O2固体后,CH3COO-浓度变化最小 | |
| D. | 常温下,水电离出c(H+)=10-10的溶液中:Na+、ClO-、S2-、NH4+不能大量共存 |
19.在11g某化合物X2S中.含S2-离子3.2g.则X的相对原子质量为( )
| A. | 23 | B. | 24 | C. | 39 | D. | 40 |
13.下列化学事实及其解释都正确的是( )
| A. | 滴有酚酞的碳酸氢钠溶液显红色,微热后红色加深,是因为碳酸氢钠分解生成了碳酸钠 | |
| B. | 用洁净的玻璃管向包有过氧化钠的脱脂棉吹气,脱脂棉燃烧,说明二氧化碳、水与过氧化钠的反应是放热反应 | |
| C. | 向溴水中滴入植物油,振荡后油层显无色,说明溴不溶于油脂 | |
| D. | 粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强 |
20.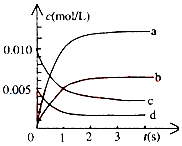 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)c({O}_{2})}$,计算:达平衡时,NO的转化率=65%,已知:K(300℃)>K(350℃),该反应是放热反应.(填“放热”或“吸热”)
(2)图中表示NO2的变化的曲线是b,用O2表示从0~2s内该反应的平均速率v(O2)=0.0015mol/(L•s).
(3)能说明该反应已经达到平衡状态的是BC.
A.单位时间内消耗a mol NO,同时生成a mol NO2
B.容器内压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效的催化剂.
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是b,用O2表示从0~2s内该反应的平均速率v(O2)=0.0015mol/(L•s).
(3)能说明该反应已经达到平衡状态的是BC.
A.单位时间内消耗a mol NO,同时生成a mol NO2
B.容器内压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效的催化剂.
17.依据图判断,下列说法不正确的是( )
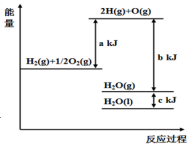

| A. | 1 mol H2(g)与$\frac{1}{2}$ mol O2(g)所具有的总能量比1 mol H2O(g)所具有的总能量高 | |
| B. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 | |
| C. | 2 mol H(g)与1 mol O(g)生成1 molH2O(g)所放出的热量是b kJ | |
| D. | 液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=2(b+c-a)kJ•mol-1 |