��Ŀ����
5���ȣ�Sr��Ϊ�������ڢ�A��Ԫ�أ��仯������ˮ�Ȼ��ȣ�SrCl2•6H2O����ʵ������Ҫ�ķ����Լ�����ҵ�ϳ�������ʯ����Ҫ�ɷ�ΪSrSO4��Ϊԭ���Ʊ�������������ͼ��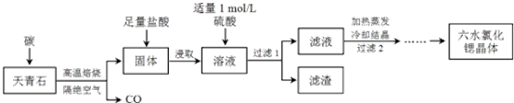
��֪���پ������ȡ����Һ�г�����Sr2+��Cl-�⣬����������Ba2+���ʣ�
��SrSO4��BaSO4���ܶȻ������ֱ�Ϊ3.3��10-7��1.1��10-10��
��SrCl2•6H2O��Ħ������Ϊ��267g/mol��
��1������ʯ����ǰ����ĥ���飬��Ŀ�������ӷ�Ӧ��ĽӴ��������߷�Ӧ���ʣ����ԭ�ϵ�ת���ʣ�
��2�������������±��գ���0.5mol SrSO4��ֻ��S����ԭ��ת����4mol���ӣ�д���÷�Ӧ�Ļ�ѧ����ʽSrSO4+4C$\frac{\underline{\;����\;}}{\;}$SrS+4CO����
��3��Ϊ�˵õ��ϴ�����ˮ�Ȼ��Ⱦ��壬����2������е�����������ϴ�ӡ����
��4�����������Ŀ���dz�ȥ��Һ��Ba2+���ʣ�Ϊ�����ԭ�ϵ������ʣ���Һ��Sr2+��Ũ��Ӧ������0.03 mol/L��ע����ʱ��Һ��Ba2+Ũ��Ϊ1��10-5 mol/L����
��5����Ʒ���ȼ�⣺��ȡ1.000g��Ʒ�ܽ�������ˮ�У������м��뺬AgNO31.100��10-2mol��AgNO3��Һ����Һ�г�Cl-�⣬����������Ag+��Ӧ�����ӣ�����Cl-��ȫ�������ú�Fe3+����Һ��ָʾ������0.2000mol/L��NH4SCN����Һ�ζ�ʣ���AgNO3��ʹʣ���Ag+��AgSCN��ɫ��������ʽ�������ٵζ���Ӧ�ﵽ�յ����������Һ����ɫ��ΪѪ��ɫ����30s����ɫ��
�����ζ�������ȥ����Ũ�ȵ�NH4SCN��Һ20.00mL�����Ʒ��SrCl2•6H2O�������ٷֺ���Ϊ93.45%������4λ��Ч���֣���
���� ������ʯ����Ҫ�ɷ�ΪSrSO4��Ϊԭ���Ʊ���ˮ�Ȼ��ȣ�SrCl2•6H2O���������̿�֪������ʯ��̼�����������±�������CO��SrS��SrS���������Һ�г�����Sr2+��Cl-�⣬����������Ba2+���ʣ�Ȼ��������������ᱵ���������Թ��˺�����Ϊ���ᱵ����Һ�к�SrSO4��SrCl2�������������ȴ�ᾧ�õ�SrCl2•6H2O��
��1����ĥ�����Ŀ�������ӷ�Ӧ��ĽӴ��������߷�Ӧ���ʣ����ԭ�ϵ�ת���ʣ�
��2��0.5mol SrSO4��ֻ��S����ԭ��ת����4mol���ӣ���1mol��Sת��8mol�ĵ��ӣ���Ӧ�����ɵ�-2�������ӣ��ݴ�д���÷�Ӧ�Ļ�ѧ����ʽ��
��3������1�����Һ�к����Ȼ��ȣ�����Һ����Ũ������ȴ�ᾧ��Ȼ�����Һ�н�������˳�����ϴ�ӳ�ȥ������������Ӳ����и��T���SrCl2•6H2O��
��4����HCl�ܽ�SrS�����Һ�к������ʱ����ӣ���������ĺ��������ᱵ�����Ӷ���ȥ��Һ��Ba2+���ʣ�
���ݱ�����Ũ�ȡ����ᱵ���ܶȻ��������������ȫ��ȥʱ��������ӵ�Ũ�ȣ�Ȼ����������ȵ��ܶȻ��������Ҫ�����ӵ���СŨ�ȣ�
��5������NH4SCN����ʣ���Ag+����γ�AgSCN��ɫ��������Һ�оͻẬ��SCN-���ͻ���Fe3+�������������Һ��Ϊ��ɫ���ݴ��жϵζ��յ㣻
�ڸ���n=cV�����n��NH4SCN����Ag+��AgSCN��ɫ��������ʽ�������ݴ˼������Һ��ʣ���Ag+�����ʵ�������Cl-��Ӧ��Ag+�����ʵ������ٸ����������غ�����1.000g��Ʒ��SrCl2•6H2O�����ʵ��������������������Ʒ���ȣ�
��� �⣺��1������ʯ����ǰ����ĥ���飬��Ŀ����Ϊ�����ӷ�Ӧ��ĽӴ���������ѧ��Ӧ���ʣ��Ӷ����ԭ�ϵ�ת���ʣ�
�ʴ�Ϊ�����ӷ�Ӧ��ĽӴ��������߷�Ӧ���ʣ����ԭ�ϵ�ת���ʣ�
��2���ڱ��յĹ�������ֻ��0.5 mol SrSO4��ֻ��S����ԭ��ת����4 mol���ӣ���1mol��Sת��8mol�ĵ��ӣ������ڷ�ӦǰԪ�صĻ��ϼ�Ϊ+6�ۣ����Է�Ӧ��Ԫ�صĻ��ϼ�Ϊ-2�ۣ����̼������ʯ�ڸ����·�����Ӧ�Ļ�ѧ����ʽΪ��SrSO4+4C$\frac{\underline{\;����\;}}{\;}$SrS+4CO����
�ʴ�Ϊ��SrSO4+4C$\frac{\underline{\;����\;}}{\;}$SrS+4CO����
��3��Ȼ����õ��ĺ���SrS�����м���HCl������Ӧ��SrS+2HCl=SrCl2+H2S��������Һ����Ũ������ȴ�ᾧ��Ȼ�����Һ�н�������˳�����ϴ�ӳ�ȥ������������Ӳ����и��T���SrCl2•6H2O��
�ʴ�Ϊ��ϴ�ӡ����
��4������HCl�ܽ�SrS�����Һ�м��������Ŀ���dz�ȥ��Һ��Ba2+���ʣ�
������Ba2+Ũ��Ϊ1��10-5 mol/L��BaSO4���ܶȻ�����Ϊ1.1��10-10������c��SO42-��=$\frac{1.1��10{\;}^{-10}}{1��10{\;}^{-5}}$mol/L=1.1��10-5mol/L����SrSO4���ܶȻ�����Ϊ3.3��10-7������c��Sr2+��=$\frac{3.3��10{\;}^{-7}}{1.1��10{\;}^{-5}}$mol/L=3.0��10-2=0.03mol/L��
�ʴ�Ϊ����ȥ��Һ��Ba2+���ʣ� 0.03��
��5������NH4SCN����ʣ���Ag+����γ�AgSCN��ɫ��������Һ�оͻẬ��SCN-���ͻ���Fe3+�������������Һ��Ϊ��ɫ����˵ζ��ﵽ�յ�ʱ��Һ����ɫ��ΪѪ��ɫ����30 s����ɫ��
�ʴ�Ϊ����Һ����ɫ��ΪѪ��ɫ����30 s����ɫ��
��n��NH4SCN��=0.2000mol/L��0.02L=4.0��10-3mol��Ag+��AgSCN��ɫ��������ʽ������������Һ��ʣ���Ag+�����ʵ���Ϊ��n��Ag+��=4.0��10-3mol������Cl-��Ӧ��Ag+�����ʵ���Ϊ��n��Ag+��=1.100��10-2 mol-4.0��10-3mol=7.0��10-3mol��
1.000g��Ʒ��SrCl2•6H2O�����ʵ���Ϊ��n��SrCl2•6H2O��=$\frac{1}{2}$��n��Ag+��=3.5��10-3mol��
1.000g��Ʒ��SrCl2•6H2O������Ϊ��m��SrCl2•6H2O��=3.5��10-3mol��267 g/mol=0.9345g��
���Բ�Ʒ����Ϊ��$\frac{0.9435g}{1g}$��100%=93.45%��
�ʴ�Ϊ��93.45%��
���� ���⿼���Ʊ�ʵ�鷽������ƣ�Ϊ��Ƶ���㣬�����Ʊ������з����Ļ�ѧ��Ӧ�����ʷ��뷽��Ϊ���Ĺؼ����漰��Ӧ���ʡ�������ԭ��Ӧ���ζ�ԭ���ȣ�ע����Ϣ����ѧ֪ʶ���ۺ�Ӧ�ã��ۺ��Խ�ǿ����Ŀ�ѶȽϴ�

| A�� | ������ˮ�����ӳɷ�Ӧ��ʹ��ˮ��ɫ | |
| B�� | ������ˮ����ȡ����Ӧ��ʹ��ˮ��ɫ | |
| C�� | ������ʹ���Ը��������Һ��ɫ | |
| D�� | ����Ũ���ᡢŨ����Ļ������ķ�Ӧ����ȡ����Ӧ |
�Ʊ���������淋�װ����ͼ1��ʾ����Ӧ�Ļ�ѧ����ʽ���£�2NH3��g��+CO2��g��?NH2COONH4��s����H��0��

ע�����Ȼ�̼��Һ��ʯ����Ϊ���Խ��ʣ�
��1���������ñ�ˮ��ȴ��ԭ���ǽ����¶ȣ���ֹ��Ӧ������ɲ���ֽ⣮��߷�Ӧ��ת���ʣ�
��2��Һ��ʯ������ƿ��������ͨ���۲����ݣ�����NH3��CO2ͨ�������
��3���ӷ�Ӧ��Ļ�����з������Ʒ��ʵ�鷽���ǹ��ˣ���д�������ƣ���Ϊ�˵õ������Ʒ��Ӧ��ȡ�ķ�����c����дѡ����ţ���
a.80���ȷ��º�� b.60���ȷ��º�� c.40���ȷ��º��
��4��β������װ����ͼ2��ʾ��˫ͨ�����ܵ����ã���ֹ������
Ũ��������ã����ն��ఱ������ֹ������ˮ�������뷴Ӧ��ʹ���������ˮ�⣮
��5��ȡ�ֱ��ʶ�����̼����淋İ����������Ʒ0.7820g��������ʯ��ˮ��ִ�����ʹ̼Ԫ����ȫת��Ϊ̼��ƣ����ˡ�ϴ�ӡ�����������Ϊ1.000g������Ʒ�а�������淋����ʵ�������Ϊ80%������ȷ��2λС����̼����狀Ͱ�������淋���Է��������ֱ�Ϊ79��78��
���� FeSO4•7H2O������Ʊ�
��6����֪��
| �������� | ��ʼ������pH | ������ȫ��pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
����һ���������м���������ϡ�����ַ�Ӧ����ַ�Ӧ����ˣ�
������Һ�������������ۣ���ֽ�����ˣ�
����Һ�еμ�NaOH��Һ���ڷ�ӦҺ��pHԼΪ5.0��5.8�����ˣ�
�ܽ��õ���Һ��������Ũ������ȴ�ᾧ�����ˣ�ϴ�ӣ����¸���õ�FeSO4•7H2O���壮
| A�� | ��������������ֲ�P��ӹ���Ʒ�������������ֱ��ȼ�������÷�ʽ֮һ | |
| B�� | ʯ�͵��ѻ����ѽⶼ�ǻ�ѧ�仯����ú��������Һ���������仯 | |
| C�� | �ø�ѹ��������������ȼ�ϵ��������Դ���õ�һ����Ҫ��ʽ | |
| D�� | ��ѧ��Ӧ�����з�Ӧ���������С����������������������������������� |
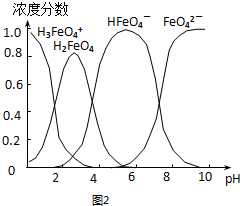
��X��Y��W�ֱ�λ�ڲ�ͬ���ڣ�
��Z��W����ͬһ���壬��W��ԭ��������Z��������
��Y��Z��W������������֮��Ϊ17��
����˵������ȷ���ǣ�������
| A�� | ԭ�Ӱ뾶��С�����˳��Ϊr��X����r��Y����r��Z����r��W�� | |
| B�� | X��Y��Z�����γ����ӻ���������γɹ��ۻ����� | |
| C�� | Z�ֱ�����X��Y��W�γɶ��ֻ����� | |
| D�� | �뵥��W�Ƚϣ�����Z�������뵥��X���� |
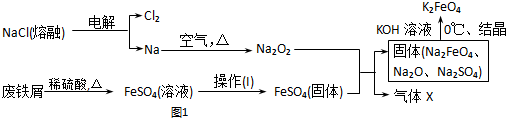
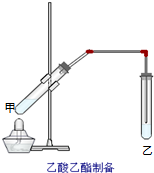 ��ͼ���Թܼ����ȼ���2mL 95%���Ҵ�������ҡ���»�������2mLŨ���ᣬ���ҡ�ȣ���ȴ���ټ���2����ˮ���ᣬ�ò�������ֽ�����Թ̶ܹ�������̨�ϣ����Թ����м���5mL���͵�̼������Һ����ͼ���Ӻ�װ�ã��þƾ��ƶ��Թܼ�С�����3��5min���ô����ȣ����۲쵽���Թ�������������ʱֹͣʵ�飮�Իش�
��ͼ���Թܼ����ȼ���2mL 95%���Ҵ�������ҡ���»�������2mLŨ���ᣬ���ҡ�ȣ���ȴ���ټ���2����ˮ���ᣬ�ò�������ֽ�����Թ̶ܹ�������̨�ϣ����Թ����м���5mL���͵�̼������Һ����ͼ���Ӻ�װ�ã��þƾ��ƶ��Թܼ�С�����3��5min���ô����ȣ����۲쵽���Թ�������������ʱֹͣʵ�飮�Իش� ��ͼ��ʵ����������������װ�ã�
��ͼ��ʵ����������������װ�ã�