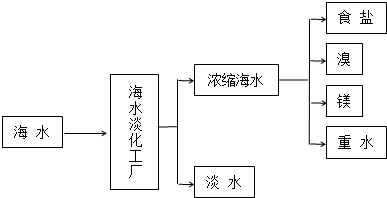
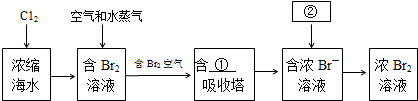
题目内容
9.下列离子方程式不正确的是( )| A. | 硫化亚铁和稀盐酸反应:FeS+2H+=Fe2++H2S↑ | |
| B. | 次氯酸钠溶液中通入少量SO2反应:SO2+H2O+ClO-=SO42-+Cl-+2H+ | |
| C. | 过氧化钠加入足量稀硫酸反应:2Na2O2+4H+═4Na++O2↑+2H2O | |
| D. | 铜粉中加入溴化铁溶液反应:2Fe3++Cu=2Fe2++Cu2+ |
分析 A.硫化亚铁和稀盐酸反应生成硫酸亚铁和硫化氢;
B.次氯酸钠具有强氧化性,能氧化二氧化硫生成硫酸根离子,自身被还原生成氯离子,因二氧化硫少量,所以有次氯酸生成;
C.过氧化钠与足量稀硫酸反应生成硫酸钠、氧气和水;
D.铜和溴化铁反应,生成溴化亚铁、溴化铜.
解答 解:A.硫化亚铁难溶于水,硫化氢为气体,两者在离子反应方程式中写化学式,所以硫化亚铁与稀硫酸反应的离子反应为FeS+2H+=Fe2++H2S↑,故A正确;
B.次氯酸钠具有强氧化性,能氧化二氧化硫生成硫酸根离子,自身被还原生成氯离子,因二氧化硫少量,所以有次氯酸生成,离子方程式为3ClO-+SO2+H2O=Cl-+SO42-+2HClO,故B错误;
C.过氧化钠、氧气、水在离子反应方程式中写化学式,所以过氧化钠加入足量稀硫酸反应,离子方程式为:2Na2O2+4H+═4Na++O2↑+2H2O,故C正确;
D.铁离子具有氧化性,铜粉中加入溴化铁溶液,离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故D正确;
故选B.
点评 本题考查离子反应的书写,明确发生的化学反应是解答本题的关键,注意离子反应的书写方法及离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
19.利用如图所示的有机物X可生产S-诱抗素Y.下列说法正确的是
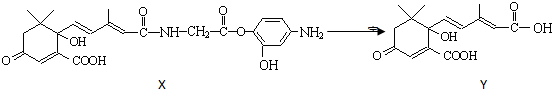 ( )
( )
 ( )
( )| A. | Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色 | |
| B. | 1 molY与足量NaOH溶液反应,最多消耗3 mol NaOH | |
| C. | 1 molX最多能加成9 molH2 | |
| D. | X可以发生氧化、取代、酯化、加聚、缩聚反应 |
4.下列表示不正确的是( )
| A. | CO2的电子式: | B. | 乙炔的结构式:H-C≡C-H | ||
| C. | CH4的比例模型: | D. | Cl-的结构示意图: |
14.某溶液在常温下由水电离出的OH-是10-13 mol/L,该溶液中一定不能大量共存的是( )
| A. | K+、CO32-、S2-、Cl- | B. | NO3-、Br-、Na+、NH4+ | ||
| C. | Na+、K+、Cl-、HS- | D. | Na+、NO3-、Fe3+、SO4- |
1.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 过氧化钠与水反应时,生成0.1molO2转移的电子数为0.2NA | |
| B. | 4.48L氨气分子中含0.6NA个N-H键 | |
| C. | 100ml0.2mol•L-1的FeCl3溶液中,含Fe3+数为0.02NA | |
| D. | 密闭容器中2molNO与1molO2充分反映,产物的分子数为2NA |
18.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1molFe溶于硝酸,电子转移数为3NA | |
| B. | 12.0gNaHSO4固体中含阳离子数为0.1NA | |
| C. | 标准状态下,22.4L氟化氢中含有氟原子数为NA | |
| D. | 7.8gNa2O2与足量的水反应转移电子数为0.2NA |
5.现有四种短周期元素的原子半径及主要化合价数据如表所示:
下列叙述不正确的是( )
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 原子半径/nm | 0.186 | 0.102 | 0.152 | 0.074 |
| 主要化合价 | +1 | +6、-2 | +1 | -2 |
| A. | 甲的最高价氧化物对应水化物的碱性比丙的强 | |
| B. | 甲单质可用电解其盐溶液的方法冶炼而得 | |
| C. | 常温下,丁的两种氢化物均为液体 | |
| D. | 乙的简单离子是四种元素各自形成的简单离子中半径最大的 |
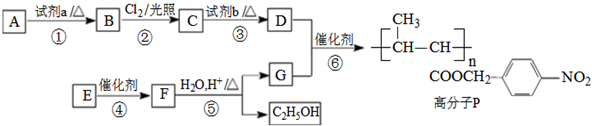
 .
.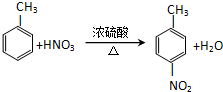 .
.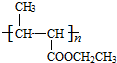 +nH2O$→_{△}^{H+}$
+nH2O$→_{△}^{H+}$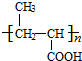 +n CH3CH2OH.
+n CH3CH2OH.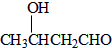 以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).