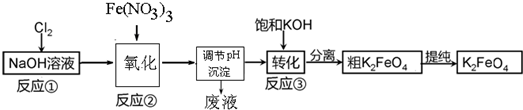
题目内容
10.如图为中学化学中几种常见物质的转化关系(部分产物已略去).已知:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做制冷剂.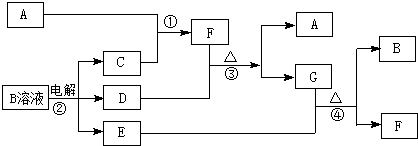
(1)写出化学式A的电子式
 ;
;(2)写出D和E溶液反应的离子方程式2OH-+Cl2=ClO-+Cl-+H2O.
(3)鉴定G中阳离子的实验方法和现象用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色;
(4)工业上电解B溶液制得一系列化工原料,写出其电解的化学方程式,并用双线桥标出电子转移的方向和数目
 .
.
分析 A、C、D是常见的气体单质,F气体极易溶于水,且液态常做致冷剂,判断为NH3;B电解生成CDE,可以初步推断是电解氯化钠溶液的产物为H2、Cl2、NaOH,所以C为H2,A为N2,D+F(NH3)=A(N2)+G,能发生反应的只能是D为Cl2,推断G为NH4Cl,G(NH4Cl)+E(NaOH)=B(NaCl)+F(NH3),符合转化关系;依据判断出的物质分析回答问题.
解答 解:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做致冷剂,判断为NH3;B电解生成CDE,可以初步推断是电解氯化钠溶液的产物为H2、Cl2、NaOH,所以C为H2,A为N2,D+F(NH3)=A(N2)+G,能发生反应的只能是D为Cl2,推断G为NH4Cl,G(NH4Cl)+E(NaOH)=B(NaCl)+F(NH3),符合转化关系,
(1)根据上面的分析,A是氮气,A的电子式为 ,
,
故答案为: ;
;
(2)D为Cl2,E为NaOH,反应的离子方程式为:2OH-+Cl2=ClO-+Cl-+H2O,故答案为:2OH-+Cl2=ClO-+Cl-+H2O;
(3)鉴定G(NH4Cl)中阳离子为NH4+,取少量氯化铵的溶液加入试管中,用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色,证明含铵根离子;
故答案为:用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色;
(4)B为氯化钠,电解氯化钠溶液的化学方程式,并用双线桥标出电子转移的方向和数目为 ,
,
故答案为: .
.
点评 本题考查无机框图的推断,较好的训练了学生对元素及化合物知识的应用以及推理问题的能力,该题的推断突破口是F的性质以及反应②,明确突破口是解答本题的关键.

| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 伴随着能量变化的物质变化都是化学变化 | |
| C. | 如图可表示Ba(OH)2•8H2O与NH4Cl晶体反应的能量变化 | |
| D. | 1L1mol/L的硫酸与足量的NaOH溶液所放出的热为中和热 |
N2(g)+2O2(g)═2NO2(g)△H=67.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ•mol-1.
下列关于肼和NO2反应的热化学方程式中正确的是( )
| A. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O (l)△H=1 135.7 kJ•mol-1 | |
| B. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(l)△H=-1 135.7 kJ•mol-1 | |
| C. | N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=1 135.7 kJ•mol-1 | |
| D. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1 135.7 kJ•mol-1 |
| A. | CO2 | B. | NH4NO3 | C. | Cl2 | D. | C6H12O6 |
| A. | 2H2 (g)+O2(g)═2H2O(g)△H1; 2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(g)+O2(g)═SO2(g)△H1; S(s)+O2(g)═SO2(g)△H2 | |
| C. | CO(g)+$\frac{1}{2}$ O2(g)═CO2(g)△H1; 2CO(g)+O2(g)═2CO2(g)△H2 | |
| D. | $\frac{1}{2}$ H2(g)+$\frac{1}{2}$ Cl2(g)═HCl(g)△H1;H2(g)+Cl2(g)═2HCl(g)△H2 |
①钢铁生锈
②酸碱中和
③浓硫酸稀释
④固体氢氧化钠溶于水
⑤H2在 Cl2中燃烧
⑥液态水变成 水蒸气
⑦NH4Cl 晶体与 Ba(OH)2•8H2O 混合搅拌
⑧工业制取水煤气.
| A. | ①②③④⑤ | B. | ①②⑤ | C. | ②③④⑤ | D. | ①⑥⑦⑧ |
| A. | 碱性:KOH>NaOH | B. | 酸性:HClO4>H2SO4 | ||
| C. | 相对原子质量:Ar>K | D. | 元素的金属性:Mg>Al |