题目内容
1.研究铁及其化合物对于工业生产具有重要意义.(1)Fe2(SO4)3和明矾一样也具有净水作用,其净水的原理是Fe3++3H2O?Fe(OH)3(胶体)+3H+(用离子方程式表示).
(2)已知某溶液中含有Fe3+、Al3+等离子,取一定量的该溶液,向其中滴加NaOH溶液,当Al(OH)3开始沉淀时,溶液中$\frac{c(F{e}^{3+})}{c(A{l}^{3+})}$为:4×10-5,已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-33.
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染.已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如图所示:
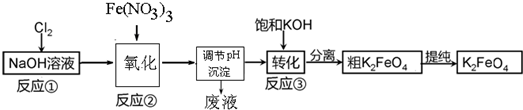
①上述氧化过程中,发生反应的离子方程式是:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,在实际生产中一般控制反应温度30℃以下,其原因是:防止生成的高铁酸钠发生分解.
②沉淀过程中加入浓KOH溶液可析出高铁酸钾(K2FeO4),这说明该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小.
③在提纯K2FeO4中采用重结晶、洗涤、低温烘干的方法,沉淀洗涤方法是用玻璃棒将蒸馏水引流至过滤装置中,让蒸馏水浸没沉淀,使水自然流下,重复操作2~3次.
④某温度下,将Cl2通入NaOH溶液中,反应后得到NaCl、NaClO、NaClO3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为11:3
(4)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示:阳极的电极反应式为Fe+8OH--6e-=FeO42-+4H2O;其中可循环使用的物质是NaOH溶液

分析 (1)三价铁离子水解产生氢氧化铁胶体,胶体表面积大,吸附能力强,达到净水目的;
(2)当Al(OH)3开始沉淀时,溶液中$\frac{c(F{e}^{3+})}{c(A{l}^{3+})}$=$\frac{c(Fe{\;}^{3+}){c}^{3}(O{H}^{-})}{c(Al{\;}^{3+}){c}^{3}(O{H}^{-})}$=$\frac{Ksp[Fe(OH){\;}_{3}]}{Ksp[Al(OH){\;}_{3}]}$,据此计算;
(3)①氯气与氢氧化钠反应产生强氧化剂次氯酸钠,硝酸铁水解产生氢氧化铁胶体,次氯酸钠将氢氧化铁氧化成高铁酸钠,据此写出氧化过程的离子方程式;已知高铁酸盐热稳定性差,在实际生产中一般控制反应温度30℃以下,其原因是防止生成的高铁酸钠发生分解;
②加入浓KOH溶液可析出高铁酸钾(K2FeO4),说明该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小;
③洗涤滤渣的方法是,将滤渣放在过滤装置中,用玻璃棒将蒸馏水引流至过滤装置中,让蒸馏水浸没沉淀,使水自然流下,重复操作2~3 次;
④Cl2生成ClO-、ClO3-化合价升高,是被氧化的过程,而Cl2生成NaCl是化合价降低被还原的过程,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,据ClO-与ClO3-的物质的量浓度之比可计算出失去电子的总物质的量,进而可计算得到电子的总物质的量;再根据氯元素被还原生成KCl的化合价变化为1计算出被还原的氯元素的物质的量,最后计算出被还原的氯元素和被氧化的氯元素的物质的量之比;
(4)依据阳极是铁,故阳极上铁放电生成FeO42-结合碱性环境来写出电极方程式;根据OH-在阳极被消耗,而在阴极会生成来分析.
解答 解:(1)三价铁离子水解产生氢氧化铁胶体,离子方程式为:Fe3++3H2O?Fe(OH)3(胶体)+3H+,胶体表面积大,吸附能力强,达到净水目的,
故答案为:Fe3++3H2O?Fe(OH)3(胶体)+3H+;
(2)当Al(OH)3开始沉淀时,溶液中$\frac{c(F{e}^{3+})}{c(A{l}^{3+})}$=$\frac{c(Fe{\;}^{3+}){c}^{3}(O{H}^{-})}{c(Al{\;}^{3+}){c}^{3}(O{H}^{-})}$=$\frac{Ksp[Fe(OH){\;}_{3}]}{Ksp[Al(OH){\;}_{3}]}$=$\frac{4.0×10{\;}^{-38}}{1.0×10{\;}^{-33}}$=4×10-5,
故答案为:4×10-5;
(3)①氯气与氢氧化钠反应产生强氧化剂次氯酸钠,硝酸铁水解产生氢氧化铁胶体,次氯酸钠将氢氧化铁氧化成高铁酸钠,离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;已知高铁酸盐热稳定性差,在实际生产中一般控制反应温度30℃以下,其原因是防止生成的高铁酸钠发生分解,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;防止生成的高铁酸钠发生分解;
②加入浓KOH溶液可析出高铁酸钾(K2FeO4),说明该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小,
故答案为:该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小;
③洗涤滤渣的方法是,将滤渣放在过滤装置中,用玻璃棒将蒸馏水引流至过滤装置中,让蒸馏水浸没沉淀,使水自然流下,重复操作2~3 次,
故答案为:用玻璃棒将蒸馏水引流至过滤装置中,让蒸馏水浸没沉淀,使水自然流下,重复操作2~3 次;
④Cl2生成ClO-与ClO3-是被氧化的过程,化合价分别由0价升高为+1价和+5价,
经测定ClO-和ClO3-物质的量之比为1:2,
则可设ClO-为1mol,ClO3-为2mol,被氧化的氯元素的物质的量为:1mol+2mol=3mol,
根据化合价变化可知,反应中失去电子的总物质的量为:1mol×(1-0)+2mol×(5-0)=11mol,
氧化还原反应中得失电子数目一定相等,则该反应中失去电子的物质的量也是11mol,
Cl2生成KCl是被还原的过程,化合价由0价降低为-1价,
则被还原的Cl的物质的量为:$\frac{11mol}{1-0}$=11mol,
所以被还原的氯元素和被氧化的氯元素的物质的量之比为11mol:3mol=11:3,
故答案为:11:3;
(4)阳极是铁,故阳极上铁放电生成FeO42-,由于是碱性环境,故电极方程式为:Fe+8OH--6e-=FeO42-+4H2O,
在电解时,水电离的H+在阴极放电:2H++2e-=H2↑,c(OH-)增大,Na+通过阳离子交换膜进入阴极区,使阴极区c(NaOH)增大,故NaOH可以循环使用,
故答案为:Fe+8OH--6e-=FeO42-+4H2O;NaOH溶液.
点评 本题考查了三价铁离子与Na2FeO4的净水原理,涉及难溶电解质的计算、氧化还原反应方程的书写、计算、电极反应的书写,综合性强,有一定难度,Na2FeO4的净水是常考点,应注意归纳总结.

 阅读快车系列答案
阅读快车系列答案| A. | 三者的单质直接与O2反应都能生成两种以上的氧化物 | |
| B. | CO2、NO2、SO2都能与H2O发生化合反应 | |
| C. | CO2、NO2、SO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 三种元素在自然界中既有游离态又有化合态 |
| A. | 16.25 | B. | 17.41 | C. | 15.51 | D. | 17.10 |

已知:
①苯胺易被氧化.
②乙酰苯胺、苯胺和醋酸的部分物理性质如表:
| 物质 | 熔点 | 沸点 | 溶解度 |
| 乙酰苯胺 | 114.3℃ | 305℃ | 微溶于冷水、易溶于热水 |
| 苯胺 | -6℃ | 184.4℃ | 微溶于水 |
| 醋酸 | 16.6℃ | 118℃ | 易溶于水 |
步骤1:在a中,加入9mL (0.10mol)苯胺、15mL(0.27mol)冰醋酸及少许锌粉,依照如图装置组装仪器.

步骤2:控制温度计读数在105℃左右,小火加热回流至反应完全.
步骤3:趁热将反应混合物倒入盛有100mL 冷水的烧杯中,冷却后抽滤(一种快速过滤方法)、洗涤,得到粗产品.
步骤4:将步骤3所得粗产品进一步提纯后,称得产品质量为10.8g.
请回答下列问题:
(1)仪器a的名称为圆底烧瓶,所选仪器a的最佳规格是B(填序号).
A.25mL B.50mL C.100mL D.250mL
(2)实验中加入少许锌粉的目的是防止苯胺被氧化,同时起着沸石的作用.
(3)步骤2中,控制温度计读数在105℃左右的原因是温度过低不能蒸出反应所生成的水或温度过高未反应的乙酸蒸出.
(4)判断反应已基本完全的方法为锥形瓶不再有水增加.
(5)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是若让反应混合物冷却,则固体析出沾在瓶壁上不易处理.
(6)步骤4中粗产品进一步提纯,该提纯方法是重结晶.
(7)本次实验的产率为80%.

 ;
; .
.
