题目内容
海洋资源的开发与利用具有广阔的前景.海水的pH一般在7.5~8.6之间.某地海水中主要离子的含量如表:
(1)海水显弱碱性的原因是(用离子方程式表示): ,该海水中Ca2+的物质的量浓度为 mol/L.
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
①阴极的电极反应式为 .
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式 .
③淡水的出口为a、b、c中的 出口.
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力.锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图2所示:
该电池电解质为能传导 Li+的固体材料.放电时该电极是电池的 极(填“正”或“负”),电极反应式为 .
(4)利用海洋资源可获得MnO2.MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾.该制备过程中消耗相同条件下空气和氯气的体积比为 (空气中氧气的体积分数按20%计).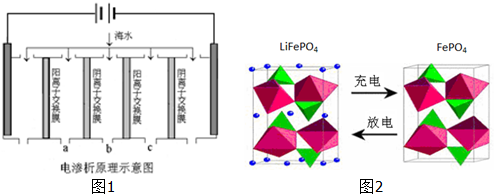
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg?L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
①阴极的电极反应式为
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式
③淡水的出口为a、b、c中的
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力.锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图2所示:
该电池电解质为能传导 Li+的固体材料.放电时该电极是电池的
(4)利用海洋资源可获得MnO2.MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾.该制备过程中消耗相同条件下空气和氯气的体积比为

考点:海水资源及其综合利用
专题:元素及其化合物
分析:(1)分析海水中存在的离子性质判断,碳酸氢根离子是弱酸阴离子水解显碱性,结合海水中钙离子含量为200mg/L,利用物质的量浓度概念计算得到;
(2)①依据电渗析法淡化海水示意图分析,阴(阳)离子交换膜仅允许阴(阳)离子通过.所以阴极上是阳离子得到电子发生还原反应;
②阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙;
③在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出;
(3)在原电池放电时,负极上失电子发生氧化反应,正极上得电子发生还原反应,根据得失电子确定正负极,根据反应物、生成物书写电极反应式;
(4)依据化学方程式定量关系计算需要氧气和氯气物质的量,空气中氧气的体积分数按20%计算空气物质的量,气体体积之比等于体积之比.
(2)①依据电渗析法淡化海水示意图分析,阴(阳)离子交换膜仅允许阴(阳)离子通过.所以阴极上是阳离子得到电子发生还原反应;
②阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙;
③在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出;
(3)在原电池放电时,负极上失电子发生氧化反应,正极上得电子发生还原反应,根据得失电子确定正负极,根据反应物、生成物书写电极反应式;
(4)依据化学方程式定量关系计算需要氧气和氯气物质的量,空气中氧气的体积分数按20%计算空气物质的量,气体体积之比等于体积之比.
解答:
解:(1)海水中存在的离子性质判断,碳酸氢根离子是弱酸阴离子水解显碱性,离子方程式为:HCO3-+H2O?H2CO3+OH-,结合海水中钙离子含量为200mg/L,物质的量浓度=
=5×10-3 mol/L;
故答案为:HCO3-+H2O?H2CO3+OH-,5×10-3 mol/L;
(2)①阴极上是阳离子得到电子发生还原反应,氢离子放电能力大于钠离子,所以电极反应为:2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑,
故答案为:2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑;
②阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙,生成碳酸钙沉淀的离子方程式为:Ca2++OH-+HCO3-=CaCO3↓+H2O,
故答案为:Ca2++OH-+HCO3-=CaCO3↓+H2O;
③在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,通过用一段时间海水中的 阴阳离子在两个电极放电,所以水在b处流出,
故答案为:b;
(3)放电时,该装置是原电池,Fe元素化合价由+3价变为+2价,得电子发生还原反应,所以该电极是正极,电极反应式为FePO4+e-+Li+=LiFePO4,
故答案为:正;FePO4+e-+Li+=LiFePO4;
(4)2MnO2+4KOH+O2═2K2MnO4+2H2O,Cl2+2K2MnO4=2KMnO4+2KCl,得到电离关系Cl2~O2反应过程中消耗相同条件下氧气和氯气的体积比=1:1,
空气中氧气的体积分数按20%计,消耗相同条件下空气和氯气的体积比=5:1,
故答案为:5:1.
| ||
| 1L |
故答案为:HCO3-+H2O?H2CO3+OH-,5×10-3 mol/L;
(2)①阴极上是阳离子得到电子发生还原反应,氢离子放电能力大于钠离子,所以电极反应为:2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑,
故答案为:2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑;
②阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙,生成碳酸钙沉淀的离子方程式为:Ca2++OH-+HCO3-=CaCO3↓+H2O,
故答案为:Ca2++OH-+HCO3-=CaCO3↓+H2O;
③在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,通过用一段时间海水中的 阴阳离子在两个电极放电,所以水在b处流出,
故答案为:b;
(3)放电时,该装置是原电池,Fe元素化合价由+3价变为+2价,得电子发生还原反应,所以该电极是正极,电极反应式为FePO4+e-+Li+=LiFePO4,
故答案为:正;FePO4+e-+Li+=LiFePO4;
(4)2MnO2+4KOH+O2═2K2MnO4+2H2O,Cl2+2K2MnO4=2KMnO4+2KCl,得到电离关系Cl2~O2反应过程中消耗相同条件下氧气和氯气的体积比=1:1,
空气中氧气的体积分数按20%计,消耗相同条件下空气和氯气的体积比=5:1,
故答案为:5:1.
点评:本题考查了化学电源新型电池,电解池原理分析判断,海水淡化的电渗析原理的分析判断,题目难度中等,掌握原理即可解答,题目难度不大.

练习册系列答案
相关题目
等质量的下列物质中,所含分子数最少的是( )
| A、Cl2 |
| B、HCl |
| C、CH4 |
| D、H2S |
一定温度下,在容积为2L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示.则下列叙述不正确的是( )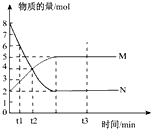

A、化学方程式中
| ||
| B、t2时N 的 v正=v逆. | ||
C、从t1到t2时刻 M的平均反应速率
| ||
| D、t3时混合气体的总物质的量不随时间的变化而变化 |
在水中加入等物质的量的AgNO3、Ba(NO3)2、NaCl、K2SO4混合均匀,取溶液,用惰性电极电解,片刻后在两个极区析出的氧化产物与还原产物的物质的质量之比为( )
| A、35.5:108 |
| B、l:2 |
| C、108:35.5 |
| D、8:1 |
设NA是阿伏加德罗常数的值,下列说法正确的是( )
| A、标准状况下,22.4L乙醇中含有的氧原子数为NA |
| B、标准状况下,1.12L16O2和1.12L18O2均含有0.1NA个氧原子 |
| C、在Na2O2与水的反应中,生成lmolO2转移的电子数为 4×6.02×1023 |
| D、25℃时,pH=13的Ba(OH)2溶液中含有OH-数目为0.2NA |
若某原子的摩尔质量为M g?mol-1,则一个该原子的真实质量是( )
| A、M g | ||
B、
| ||
C、
| ||
D、
|
恒温、恒压下,a mol A和b mol B在一个容积可变的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )
| A、物质A、B的转化率之比为a:b | ||
| B、当v正(A)=2v逆(B)时,可确定反应达到平衡 | ||
C、起始时刻和达到平衡后容器中的压强比为(a+b):(a+b-
| ||
| D、若起始时放入2a mol A和2b mol B,则达到平衡时生成2n mol C |