题目内容
有一应用前景广阔的纳米材料甲,其由A、B两种短周期非金属元素组成,熔点高,硬度大,难溶于水.取1.40g材料甲与熔融的烧碱反应,生成一种含A的含氧酸盐乙和一种含B的气体丙,测得丙在标准状况下的体积为0.896L.
乙能溶于水,加盐酸产生白色胶状沉淀,盐酸过量沉淀不溶解;丙能使湿润的红色石蕊试纸变蓝.
(1)甲的化学式为 ,属于 晶体,丙的电子式为
(2)工业上制备甲的方法之一是用A的氯化物与丙在高温下反应,则其化学反应方程式为 ,该反应属于 (填“氧化还原反应”或“非氧化还原反应”)
(3)乙的水溶液露置在空气中容易变质,写出相应的离子方程式
(4)工业上以废铜为原料经一系列化学反应可生产氯化亚铜(CuCl),其工艺流程如图所示:
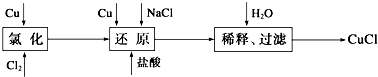
试根据图转化回答下列问题:
①还原过程中的产物为Na[CuCl2],试写出反应的化学方程式 .制备中当氯化完成后必须经还原过程再制得CuCl,为什么不用一步法制得CuCl?(已知Cu2++Cu+2Cl-═2CuCl↓) .
②实验室中在CuCl2热溶液中通入SO2气体也可制备白色的CuCl沉淀,试写出该反应的离子方程式 .
乙能溶于水,加盐酸产生白色胶状沉淀,盐酸过量沉淀不溶解;丙能使湿润的红色石蕊试纸变蓝.
(1)甲的化学式为
(2)工业上制备甲的方法之一是用A的氯化物与丙在高温下反应,则其化学反应方程式为
(3)乙的水溶液露置在空气中容易变质,写出相应的离子方程式
(4)工业上以废铜为原料经一系列化学反应可生产氯化亚铜(CuCl),其工艺流程如图所示:

试根据图转化回答下列问题:
①还原过程中的产物为Na[CuCl2],试写出反应的化学方程式
②实验室中在CuCl2热溶液中通入SO2气体也可制备白色的CuCl沉淀,试写出该反应的离子方程式
考点:铜金属及其重要化合物的主要性质,氧化还原反应
专题:元素及其化合物
分析:测得丙在标准状况下的体积为0.896L,物质的量=
=0.04mol,丙能使湿润的红色石蕊试纸变蓝,说明丙气体是氨气,乙是含A的含氧酸盐,乙能溶于水,加盐酸产生白色胶状沉淀,盐酸过量沉淀不溶解,判断是生成的硅酸沉淀由此推断A为Si元素,B为N元素,结合元素化合价,甲由A、B两种短周期非金属元素组成,熔点高,硬度大,难溶于水,判断为Si3N4,;
(1)依据分析判断书写化学式和电子式,结合物质性质判断物质类型;
(2)根据反应物和生成物结合原子守恒计算书写化学方程式;
(3)碳酸酸性大于硅酸,硅酸盐和二氧化碳反应生成硅酸;
(4)①流程分析可知,铜和氯气反应生成氯化铜,加入铜、氯化钠和盐酸还原得到产物为Na[CuCl2],结合原子守恒配平书写;
②氯化铜溶液中通入二氧化硫具有还原性,还原得到白色的CuCl沉淀,二氧化硫被氧化为硫酸;
| 0.896L |
| 22.4L/mol |
(1)依据分析判断书写化学式和电子式,结合物质性质判断物质类型;
(2)根据反应物和生成物结合原子守恒计算书写化学方程式;
(3)碳酸酸性大于硅酸,硅酸盐和二氧化碳反应生成硅酸;
(4)①流程分析可知,铜和氯气反应生成氯化铜,加入铜、氯化钠和盐酸还原得到产物为Na[CuCl2],结合原子守恒配平书写;
②氯化铜溶液中通入二氧化硫具有还原性,还原得到白色的CuCl沉淀,二氧化硫被氧化为硫酸;
解答:
解:题干信息可知,测得丙在标准状况下的体积为0.896L,物质的量=
=0.04mol,丙能使湿润的红色石蕊试纸变蓝,说明丙气体是氨气,乙是含A的含氧酸盐,乙能溶于水,加盐酸产生白色胶状沉淀,盐酸过量沉淀不溶解,判断是生成的硅酸沉淀由此推断A为Si元素,B为N元素,结合元素化合价,甲由A、B两种短周期非金属元素组成,熔点高,硬度大,难溶于水,判断为Si3N4,;
(1)上述分析可知甲为Si3N4,依据熔点高,硬度大,难溶于水性质分析可知是原子晶体,氨气是氮原子和氢原子形成共价键形成的共价化合物,电子式为: ;
;
故答案为:Si3N4,原子, ;
;
(2)工业上制备甲的方法之一是用A的氯化物为SiCl4,与丙为NH3在高温下反应生成Si3N4和HCl,则其化学反应方程式为:3SiCl4+4NH3=Si3N4+12HCl,反应前后元素化合价都不变属于非氧化还原反应;
故答案为:3SiCl4+4NH3=Si3N4+12HCl,非氧化还原反应;
(3)乙为Na2SiO3,水溶液露置在空气中容易变质是和空气中二氧化碳反应生成硅酸和碳酸钠,反应的离子方程式为:SiO32-+CO2+H2O=H2SiO3↓+CO32-;
故答案为:SiO32-+CO2+H2O=H2SiO3↓+CO32-;
(4)①流程分析可知,铜和氯气反应生成氯化铜,加入铜、氯化钠和盐酸还原得到产物为Na[CuCl2],结合原子守恒配平书写化学方程式为:CuCl2+2NaCl+Cu═2Na[CuCl2];制备中当氯化完成后必须经还原过程再制得CuCl的原因是CuCl沉淀沉积在Cu表面阻碍反应的进行;
故答案为:CuCl2+2NaCl+Cu═2Na[CuCl2];CuCl沉淀沉积在Cu表面阻碍反应的进行;
②氯化铜溶液中通入二氧化硫具有还原性,还原得到白色的CuCl沉淀,二氧化硫被氧化为硫酸,反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O
2CuCl+4H++SO42-;
故答案为:2Cu2++2Cl-+SO2+2H2O
2CuCl+4H++SO42-;
| 0.896L |
| 22.4L/mol |
(1)上述分析可知甲为Si3N4,依据熔点高,硬度大,难溶于水性质分析可知是原子晶体,氨气是氮原子和氢原子形成共价键形成的共价化合物,电子式为:
 ;
;故答案为:Si3N4,原子,
 ;
;(2)工业上制备甲的方法之一是用A的氯化物为SiCl4,与丙为NH3在高温下反应生成Si3N4和HCl,则其化学反应方程式为:3SiCl4+4NH3=Si3N4+12HCl,反应前后元素化合价都不变属于非氧化还原反应;
故答案为:3SiCl4+4NH3=Si3N4+12HCl,非氧化还原反应;
(3)乙为Na2SiO3,水溶液露置在空气中容易变质是和空气中二氧化碳反应生成硅酸和碳酸钠,反应的离子方程式为:SiO32-+CO2+H2O=H2SiO3↓+CO32-;
故答案为:SiO32-+CO2+H2O=H2SiO3↓+CO32-;
(4)①流程分析可知,铜和氯气反应生成氯化铜,加入铜、氯化钠和盐酸还原得到产物为Na[CuCl2],结合原子守恒配平书写化学方程式为:CuCl2+2NaCl+Cu═2Na[CuCl2];制备中当氯化完成后必须经还原过程再制得CuCl的原因是CuCl沉淀沉积在Cu表面阻碍反应的进行;
故答案为:CuCl2+2NaCl+Cu═2Na[CuCl2];CuCl沉淀沉积在Cu表面阻碍反应的进行;
②氯化铜溶液中通入二氧化硫具有还原性,还原得到白色的CuCl沉淀,二氧化硫被氧化为硫酸,反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O
| ||
故答案为:2Cu2++2Cl-+SO2+2H2O
| ||
点评:本题考查学生对元素及其化合物的主要性质的掌握、书写化学方程式、阅读题目获取新信息能力、对工艺流程的理解等,难度中等,需要学生具备扎实的基础与综合运用知识、信息分析解决问题能力.

练习册系列答案
相关题目
下列物质的分类合理的是( )
| A、氧化物:CO2 NO SO2 H2O |
| B、碱:NaOH KOH Ba(OH)2 Na2CO3 |
| C、铵盐:NH4Cl NH4NO3 (NH4)2SO4 NH3?H2O |
| D、碱性氧化物:Na2O CaO Mn2O7 MgO |
下列离子方程式不正确的是( )
| A、石英与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O |
| B、硅与烧碱溶液反应:Si+2OH-+H2O═SiO32-+2H2↑ |
| C、向小苏打溶液中加入过量的石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
| D、往水玻璃中加入盐酸:2H++SiO32-═H2SiO3↓ |
以下说法不正确的是( )
| A、从元素周期表中可以获取元素名称、原子序数、相对原子质量等信息 |
| B、物质本身没有好与坏之分,而人们对物质的应用却存在合理与不合理之分 |
| C、对于化学变化,根据不同的需求,人们需要控制反应条件促进或抑制反应的发生 |
| D、科学家创建元素符号、化学方程式等化学用语,是为了增加化学科学的神秘色彩 |
下列关于铜的说法中,不正确的是( )
| A、铜是一种紫红色金属 |
| B、铜是热和电的良导体 |
| C、铜在自然界中主要以单质的形式存在 |
| D、铜是人类使用最早、应用最广泛的金属之一 |
用惰性电极电解下列溶液,一段时间后,阴极质量增加,电解液的pH下降的是( )
①CuSO4 ②BaCl2 ③AgNO3 ④H2SO4.
①CuSO4 ②BaCl2 ③AgNO3 ④H2SO4.
| A、①② | B、②④ | C、①④ | D、①③ |
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:下列叙述正确的是( )
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1. 实验测得起始、平衡时的有关数据如下表:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1. 实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A、反应的速率:③>①>② |
| B、达到平衡时氨气的浓度:①>② |
| C、放出的热量(kJ):a<b<92.4 |
| D、反应得到1mol NH3(l),放出热量46.2kJ |