题目内容
20.下面有关晶体的叙述中,不正确的是( )| A. | 在石墨晶体中,每一层中的C原子均以共价键结合,所以石墨是原子晶体 | |
| B. | 氯化钠晶体中,每个Na+周围距离相等的Na+共有8个 | |
| C. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| D. | 金刚石网状结构中,由共价键形成的碳原子环中,最小环上有6个碳原子 |
分析 A.石墨晶体层与层之间是分子间作用力,每一层中的C原子均以共价键结合;
B.氯化钠晶胞中,每个钠离子周围距离最近的钠离子是12个;
C.氯化铯晶体中,铯离子的配位数是8;
D.金刚石晶体中,每个最小的环上含有6个碳原子.
解答 解:A.石墨晶体层与层之间是分子间作用力,每一层中的C原子均以共价键结合,所以石墨晶体中的作用力有共价键、分子间作用力,是一种混合晶体,故A错误;
B.氯化钠晶胞中,每个钠离子周围距离最近的钠离子个数=3×8÷2=12,故B错误;
C.氯化铯晶体中,铯离子的配位数是8,所以每个Cs+周围紧邻8个Cl-,故C正确;
D.金刚石网状结构中,每个碳原子含有4个共价键,由共价键形成的碳原子环中,最小的环上有6个碳原子,故D正确.
故选AB.
点评 本题考查了晶体的空间结构,明确典型的晶体类型、结构、晶胞为解答本题关键,同时要求学生有丰富的空间想象能力,难度较大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
6.化学与生产、生活密切相关,下列说法不正确的是( )
| A. | Fe2O3常用作红色油漆和涂料 | B. | 生物柴油与柴油的化学成分相同 | ||
| C. | 聚丙烯酸钠可做“尿不湿”原料 | D. | 液氯或浓硫酸可用钢瓶储存 |
11.下列各项中,表达正确的是( )
| A. | 质量数为12的碳原子符号:${\;}_{12}^{12}$C | |
| B. | 氧原子的结构示意图: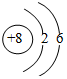 | |
| C. | CO2分子的电子式: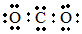 | |
| D. | 乙炔的结构简式:CH2=CH2 |
8.合成导电高分子化合物PPV的反应为:

下列说法正确的是( )

下列说法正确的是( )
| A. | 1 mol  最多可与2 mol H2发生反应 最多可与2 mol H2发生反应 | |
| B. | PPV与聚苯乙烯的最小结构单元组成相同 | |
| C. | 该反应为缩聚反应 | |
| D. | PPV是聚苯乙炔 |
15.下列说法不正确的是( )
| A. | 目前加碘食盐中含碘元素的物质主要是KIO3 | |
| B. | 维生素C具有还原性,可用作食品抗氧化剂 | |
| C. | 向含有Hg2+的废水中加入Na2S,使Hg2+转化成HgS沉淀除去 | |
| D. | 淀粉、油脂和蛋白质都是天然高分子化合物,都能发生水解反应 |
12.化学与生活密切相关.下列生活中常见物质的俗名与化学式相对应的是( )
| A. | 苏打--NaHCO3 | B. | 醋酸--C2H5OH | C. | 明矾-KAl(SO4)2 | D. | 生石灰-CaO |
9.化学与材料、生活和环境密切相关,下列有关说法中错误的是( )
| A. | 蚊虫叮咬处涂抹肥皂水可止痛痒 | |
| B. | 大力实施矿物燃料脱硫脱硝技术,能减少硫、氮氧化物的排放 | |
| C. | 明矾净水时发生了化学及物理变化,能起到净水作用,而没有杀菌、消毒的作用 | |
| D. | 铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝单质 |
10.地球表面十公里厚的地层中,含钛元素达千分之六,比铜多61倍,金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值.氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系,列反应可以制得Ti3N4和纳米TiO2(如图1).

图中的M是短周期金属元素,M的部分电离能如表:
请回答下列问题:
(1)TiO2为离子晶体,己知晶体中阳离子的配位数为6,阴离子的配位数为3,则阳离子的电子排布式为1s22s22p63s23p6
(2)金属Ti与金属M的晶体原子堆积模式相同,其堆积模型为六方最密堆积 (填写堆积模型名称),晶体中原子在二维平面里的配位数为6
(3)室温下TiCl4为无色液体,沸点为136.4℃,由此可知其晶体类型为分子晶体,构成该晶体的粒子的空间构型为正四面体
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如2图所示,已知该氮化钛的密度为p g•cm-3,则该晶胞中N、Ti之间的最近距离为$\frac{1}{2}\root{3}{\frac{4×62}{ρ{N}_{A}}}×1{0}^{10}$ pm,(NA为阿伏加德常数的数值,只列算式).该晶体中与Ti原子距离相等且最近的Ti原子有12 个.
(5)科学家通过X射线探明KC1、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据如表:
KC1、CaO、TiN三种离子晶体硬度由低到该的顺序为KCl<CaO<TiN.

图中的M是短周期金属元素,M的部分电离能如表:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/(kJ•mol-1) | 738 | 1451 | 7733 | 10 540 | 13 630 |
(1)TiO2为离子晶体,己知晶体中阳离子的配位数为6,阴离子的配位数为3,则阳离子的电子排布式为1s22s22p63s23p6
(2)金属Ti与金属M的晶体原子堆积模式相同,其堆积模型为六方最密堆积 (填写堆积模型名称),晶体中原子在二维平面里的配位数为6
(3)室温下TiCl4为无色液体,沸点为136.4℃,由此可知其晶体类型为分子晶体,构成该晶体的粒子的空间构型为正四面体
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如2图所示,已知该氮化钛的密度为p g•cm-3,则该晶胞中N、Ti之间的最近距离为$\frac{1}{2}\root{3}{\frac{4×62}{ρ{N}_{A}}}×1{0}^{10}$ pm,(NA为阿伏加德常数的数值,只列算式).该晶体中与Ti原子距离相等且最近的Ti原子有12 个.
(5)科学家通过X射线探明KC1、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据如表:
| 离子晶体 | NaCl | KC1 | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |