题目内容
6.化学与生产、生活密切相关,下列说法不正确的是( )| A. | Fe2O3常用作红色油漆和涂料 | B. | 生物柴油与柴油的化学成分相同 | ||
| C. | 聚丙烯酸钠可做“尿不湿”原料 | D. | 液氯或浓硫酸可用钢瓶储存 |
分析 A.氧化铁为红棕色固体;
B.柴油是由多种烃组成的混合物,而生物柴油是含氧量极高的复杂有机成分的混合物;
C.聚丙烯酸钠具有强的吸水性;
D.常温下Fe与氯气不反应,遇浓硫酸发生钝化.
解答 解:A.氧化铁为红棕色固体,常用于做红色油漆和涂料,故A正确;
B.柴油是由多种烃组成的混合物,而生物柴油是含氧量极高的复杂有机成分的混合物,二者成分不同,故B错误;
C.聚丙烯酸钠具有强的吸水性,可做“尿不湿”原料,故C正确;
D.常温下Fe与氯气不反应,遇浓硫酸发生钝化,则用钢瓶储存液氯或浓硫酸,故D正确;
故选:B.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
16.高铁酸钾(K2FeO4,4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-)是一种新型的自来水处理剂,它的性质和作用是( )
| A. | 有强氧化性,可消毒杀菌,还原产物能吸附水中杂质 | |
| B. | 有强还原性,可消毒杀菌,氧化产物能吸附水中杂质 | |
| C. | 有强氧化性,能吸附水中杂质,还原产物能消毒杀菌 | |
| D. | 有强还原性,能吸附水中杂质,氧化产物能消毒杀菌 |
17.卤块主要成分是MgCl2,还含此外还含Fe2+、Fe3+和Mn2+等杂质离子.以卤块为原料按如图所示流程进行生产,可制得轻质氧化镁.
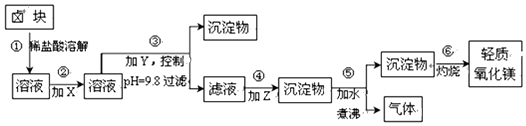
相关数据:
请根据表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的a、c、d(选填试剂编号).
(2)步骤②发生反应的离子方程式为2Fe2++ClO-+2H+=Cl-+2Fe3++H2O;步骤⑤中发生反应的化学方程为MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑.
(3)为尽量除去杂质,步骤③控制pH为9.8时,停止加入Y.调节为该pH的目的是使Mg2+以外的杂质尽可能彻底地转化为沉淀除去.
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是ABCE.
A.酒精喷灯 B.铁三角架 C.坩埚 D.蒸发皿 E.泥三角 F.烧杯 G.石棉网
(5)已知在25℃时,Ksp[Mg(OH)2)=3.2×10-11,向0.02mol•L-1的MgCL2溶液中加入NaOH固体,如要生成Mg( OH )2沉淀,应使溶液中的c( OH-)最小为4×10-5 mol•L-1.
(6)为了分析制取的产品中残留铁元素的含量,取5g产品,先将Fe3+预处理为Fe2+后配制成100mL溶液,取25.00mL,用0.01mol•L-1KMnO4标准溶液在酸性条件下进行滴定.
①滴定前是否要滴加指示剂?否(填“是”或“否”),请说明理由KMnO4溶液的紫红色可指示反应终点.
②终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是4.480%.
(7)判断下列操作对测定结果的影响(填“偏高“、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的KMnO4溶液有少量溅出,使测定结果偏高.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果偏低.

相关数据:
| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6 | b.双氧水(含30%H2O2) | 1500 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2200 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO) | 800 |
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的a、c、d(选填试剂编号).
(2)步骤②发生反应的离子方程式为2Fe2++ClO-+2H+=Cl-+2Fe3++H2O;步骤⑤中发生反应的化学方程为MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑.
(3)为尽量除去杂质,步骤③控制pH为9.8时,停止加入Y.调节为该pH的目的是使Mg2+以外的杂质尽可能彻底地转化为沉淀除去.
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是ABCE.
A.酒精喷灯 B.铁三角架 C.坩埚 D.蒸发皿 E.泥三角 F.烧杯 G.石棉网
(5)已知在25℃时,Ksp[Mg(OH)2)=3.2×10-11,向0.02mol•L-1的MgCL2溶液中加入NaOH固体,如要生成Mg( OH )2沉淀,应使溶液中的c( OH-)最小为4×10-5 mol•L-1.
(6)为了分析制取的产品中残留铁元素的含量,取5g产品,先将Fe3+预处理为Fe2+后配制成100mL溶液,取25.00mL,用0.01mol•L-1KMnO4标准溶液在酸性条件下进行滴定.
①滴定前是否要滴加指示剂?否(填“是”或“否”),请说明理由KMnO4溶液的紫红色可指示反应终点.
②终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是4.480%.
(7)判断下列操作对测定结果的影响(填“偏高“、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的KMnO4溶液有少量溅出,使测定结果偏高.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果偏低.
1.化学与社会、生活密切相关.下列说法不正确的是( )
| A. | 将“地沟油”制成肥皂,可以提高资源的利用率 | |
| B. | 用Al(OH)3可以做塑料的阻燃剂,因为它受热熔化放出大量的热 | |
| C. | 海底可燃冰开发不当释放出的甲烷会造成温室效应的加剧 | |
| D. | 可以用钢瓶储存液氯或浓硫酸 |
11.下列有关说法正确的是( )
| A. | 加热坩埚中的硫酸铜晶体,失水后须在干燥器中冷却,再称量 | |
| B. | 检验蔗糖水解产物是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2悬浊液并加热 | |
| C. | 用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低 | |
| D. | 做锌铜稀硫酸原电池实验时,反应一段时间后锌片表面还是呈银白色 |
2.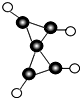 科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中黑圆代表碳原子,白圆代表氢原子,下列说法中不正确的是( )
科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中黑圆代表碳原子,白圆代表氢原子,下列说法中不正确的是( )
 科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中黑圆代表碳原子,白圆代表氢原子,下列说法中不正确的是( )
科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中黑圆代表碳原子,白圆代表氢原子,下列说法中不正确的是( )| A. | 该分子的分子式C5H4 | |
| B. | 1mol该物质完全燃烧生成CO2与H2O时需耗6 mol O2 | |
| C. | 该物质完全燃烧生成的CO2与H2O的分子数比为5:4 | |
| D. | 1mol该物质完全燃烧生成CO2与H2O时转移电子数为24 NA |
19.下列检验或实验操作正确的是( )
| A. | 只用蒸馏水无法鉴别一瓶无色液体是苯还是水 | |
| B. | 碘的苯溶液呈紫色,可用蒸馏法将其进一步分离 | |
| C. | 蒸发完成时,用手直接取下蒸发皿放在石棉网上 | |
| D. | 已知汽油是无色液体,不溶于水,密度小于水,分离水和汽油的最合理方法为蒸馏 |
20.下面有关晶体的叙述中,不正确的是( )
| A. | 在石墨晶体中,每一层中的C原子均以共价键结合,所以石墨是原子晶体 | |
| B. | 氯化钠晶体中,每个Na+周围距离相等的Na+共有8个 | |
| C. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| D. | 金刚石网状结构中,由共价键形成的碳原子环中,最小环上有6个碳原子 |
 →
→ .
.