题目内容
11.下列各项中,表达正确的是( )| A. | 质量数为12的碳原子符号:${\;}_{12}^{12}$C | |
| B. | 氧原子的结构示意图: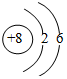 | |
| C. | CO2分子的电子式: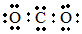 | |
| D. | 乙炔的结构简式:CH2=CH2 |
分析 A.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
B.氧原子的核电荷数为8,原子核外电子数为8;
C.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子;
D.乙炔含有碳碳叁键.
解答 解:A.质量数为12的碳原子,其质子数为6,该氧原子可以表示为:612C,故A错误;
B.氧原子的核电荷数为8,原子核外电子数为8,原子的结构示意图: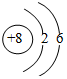 ,故B正确;
,故B正确;
C.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,则其正确的电子式为 ,故C错误;
,故C错误;
D.乙炔含有碳碳叁键,则乙炔的结构简式为CH≡CH,故D错误;
故选B.
点评 本题考查了常见化学用语的书写,题目难度中等,涉及电子式、原子结构示意图、元素符号、结构简式知识,注意掌握常见化学用语的概念及书写原则,审题培养了学生规范答题的能力.

练习册系列答案
相关题目
17.卤块主要成分是MgCl2,还含此外还含Fe2+、Fe3+和Mn2+等杂质离子.以卤块为原料按如图所示流程进行生产,可制得轻质氧化镁.
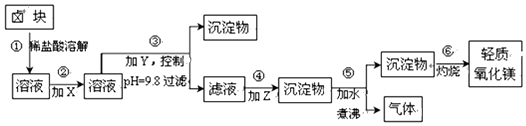
相关数据:
请根据表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的a、c、d(选填试剂编号).
(2)步骤②发生反应的离子方程式为2Fe2++ClO-+2H+=Cl-+2Fe3++H2O;步骤⑤中发生反应的化学方程为MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑.
(3)为尽量除去杂质,步骤③控制pH为9.8时,停止加入Y.调节为该pH的目的是使Mg2+以外的杂质尽可能彻底地转化为沉淀除去.
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是ABCE.
A.酒精喷灯 B.铁三角架 C.坩埚 D.蒸发皿 E.泥三角 F.烧杯 G.石棉网
(5)已知在25℃时,Ksp[Mg(OH)2)=3.2×10-11,向0.02mol•L-1的MgCL2溶液中加入NaOH固体,如要生成Mg( OH )2沉淀,应使溶液中的c( OH-)最小为4×10-5 mol•L-1.
(6)为了分析制取的产品中残留铁元素的含量,取5g产品,先将Fe3+预处理为Fe2+后配制成100mL溶液,取25.00mL,用0.01mol•L-1KMnO4标准溶液在酸性条件下进行滴定.
①滴定前是否要滴加指示剂?否(填“是”或“否”),请说明理由KMnO4溶液的紫红色可指示反应终点.
②终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是4.480%.
(7)判断下列操作对测定结果的影响(填“偏高“、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的KMnO4溶液有少量溅出,使测定结果偏高.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果偏低.

相关数据:
| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6 | b.双氧水(含30%H2O2) | 1500 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2200 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO) | 800 |
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的a、c、d(选填试剂编号).
(2)步骤②发生反应的离子方程式为2Fe2++ClO-+2H+=Cl-+2Fe3++H2O;步骤⑤中发生反应的化学方程为MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑.
(3)为尽量除去杂质,步骤③控制pH为9.8时,停止加入Y.调节为该pH的目的是使Mg2+以外的杂质尽可能彻底地转化为沉淀除去.
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是ABCE.
A.酒精喷灯 B.铁三角架 C.坩埚 D.蒸发皿 E.泥三角 F.烧杯 G.石棉网
(5)已知在25℃时,Ksp[Mg(OH)2)=3.2×10-11,向0.02mol•L-1的MgCL2溶液中加入NaOH固体,如要生成Mg( OH )2沉淀,应使溶液中的c( OH-)最小为4×10-5 mol•L-1.
(6)为了分析制取的产品中残留铁元素的含量,取5g产品,先将Fe3+预处理为Fe2+后配制成100mL溶液,取25.00mL,用0.01mol•L-1KMnO4标准溶液在酸性条件下进行滴定.
①滴定前是否要滴加指示剂?否(填“是”或“否”),请说明理由KMnO4溶液的紫红色可指示反应终点.
②终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是4.480%.
(7)判断下列操作对测定结果的影响(填“偏高“、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的KMnO4溶液有少量溅出,使测定结果偏高.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果偏低.
2.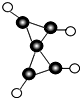 科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中黑圆代表碳原子,白圆代表氢原子,下列说法中不正确的是( )
科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中黑圆代表碳原子,白圆代表氢原子,下列说法中不正确的是( )
 科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中黑圆代表碳原子,白圆代表氢原子,下列说法中不正确的是( )
科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中黑圆代表碳原子,白圆代表氢原子,下列说法中不正确的是( )| A. | 该分子的分子式C5H4 | |
| B. | 1mol该物质完全燃烧生成CO2与H2O时需耗6 mol O2 | |
| C. | 该物质完全燃烧生成的CO2与H2O的分子数比为5:4 | |
| D. | 1mol该物质完全燃烧生成CO2与H2O时转移电子数为24 NA |
19.下列检验或实验操作正确的是( )
| A. | 只用蒸馏水无法鉴别一瓶无色液体是苯还是水 | |
| B. | 碘的苯溶液呈紫色,可用蒸馏法将其进一步分离 | |
| C. | 蒸发完成时,用手直接取下蒸发皿放在石棉网上 | |
| D. | 已知汽油是无色液体,不溶于水,密度小于水,分离水和汽油的最合理方法为蒸馏 |
16.某混合气体可能含有N2、HCl、CO,依次进行如下处理,(假定每次处理均完全)( )
(1)通过足量的碳酸氢钠溶液和灼热的氧化铜,气体体积都没有变化;
(2)通过足量的过氧化钠固体,气体体积减小;
(3)通过灼热的铜网,经充分反应后气体体积又减小,但还剩余气体,由此可以确定原混合气体中.
(1)通过足量的碳酸氢钠溶液和灼热的氧化铜,气体体积都没有变化;
(2)通过足量的过氧化钠固体,气体体积减小;
(3)通过灼热的铜网,经充分反应后气体体积又减小,但还剩余气体,由此可以确定原混合气体中.
| A. | 一定没有N2,HCl 和CO中至少有一种 | |
| B. | 一定有N2,HCl 和CO | |
| C. | 一定有N2HCl 和CO中至少有一种 | |
| D. | 一定有N2 和HCl,没有CO |
3.下列叙述正确的是( )
| A. | 标准状况下,22.4 水中含有的氧原子数约为6.02×1023 | |
| B. | 常温下,等物后的量的甲烷和一氧化碳所含有对分子数一定相等 | |
| C. | 1L一氧化碳气体一定比1L氧气对质量小 | |
| D. | 气体摩尔体积是指1mol任何气体所占的体积,约为22.4L |
20.下面有关晶体的叙述中,不正确的是( )
| A. | 在石墨晶体中,每一层中的C原子均以共价键结合,所以石墨是原子晶体 | |
| B. | 氯化钠晶体中,每个Na+周围距离相等的Na+共有8个 | |
| C. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| D. | 金刚石网状结构中,由共价键形成的碳原子环中,最小环上有6个碳原子 |
1.下列有关胶体的说法正确的是( )
| A. | 胶体是纯净物,氢氧化铁胶体带正电 | |
| B. | 胶体与溶液的本质区别是有丁达尔效应 | |
| C. | 将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 | |
| D. | 胶体属于介稳体系 |