题目内容
16.下列表示式错误的是( )| A. | Al3+的结构示意图: | B. | 氯化钠的电子式: | ||
| C. | 铝离子的电子式:Al3+ | D. | 铝原子的结构示意图: |
分析 A.铝离子最外层达到8电子稳定结构;
B.氯化钠为离子化合物,阴阳离子需要标出所带电荷,阴离子还要标出最外层电子;
C.铝离子为简单阳离子,其电子式直接用离子符号表示;
D.氯原子的核电荷数=核外电子总数=13,最外层含有3个电子.
解答 解:A. 为氯原子结构示意图,Al3+最外层含有8个电子,其正确的离子结构示意图为:
为氯原子结构示意图,Al3+最外层含有8个电子,其正确的离子结构示意图为: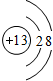 ,故A错误;
,故A错误;
B.氯化钠属于离子化合物,钠离子直接用离子符号表示,氯离子需要标出所带电荷及最外层电子,氯化钠的电子式为 ,故B正确;
,故B正确;
C.铝离子为简单阳离子,其电子式为其离子符号,铝离子的电子式为Al3+,故C正确;
D.氯原子的核电荷数、核外电子总数都是13,最外层含有3个电子,其原子结构示意图为: ,故D正确;
,故D正确;
故选A.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、离子结构示意图、原子结构示意图等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
7.单斜硫和正交硫是硫的两种同素异形体
已知:①S(单斜,s)+O2(g)═SO2(g)△H1=-297.16kJ•mol-1
②S(正交,s)+O2(g)═SO2(g)△H2=-296.83kJ•mol-1
③S(单斜,s)═S(正交,s)△H3
下列说法正确的是( )
已知:①S(单斜,s)+O2(g)═SO2(g)△H1=-297.16kJ•mol-1
②S(正交,s)+O2(g)═SO2(g)△H2=-296.83kJ•mol-1
③S(单斜,s)═S(正交,s)△H3
下列说法正确的是( )
| A. | △H3=+0.33 kJ•mol-1 | |
| B. | 单斜硫转化为正交硫的反应是吸热反应 | |
| C. | △H3<0,正交硫比单斜硫稳定 | |
| D. | △H3>0,单斜硫比正交硫稳定 |
4.下列物质中,既能发生消去反应,又能氧化成醛的是( )
| A. |  | B. |  | C. |  | D. |  |
11.某原电池装置如图所示,盐桥中装有用饱和氯化钾溶液浸泡过的琼脂.下列叙述正确的是( )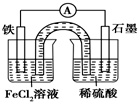

| A. | 原电池工作一段时间后,FeCl2溶液中c(Cl-)增大 | |
| B. | 此电池工作原理与硅太阳能电池工作原理相同 | |
| C. | Fe为正极,石墨上发生的反应为2H++2e-═H2↑ | |
| D. | 该装置中的盐桥完全可用金属导线代替 |
5. 硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
(1)新制的绿矾(FeSO4•7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:4FeSO4•7H2O+O2=4Fe(OH)SO4+26H2O.
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃.
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”.
上述装置Ⅲ和Ⅳ用来检验气体产物.试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在50℃(选填“0℃、25℃、50℃”),装置Ⅱ的作用是防止产生倒吸.
②装置Ⅲ中的试剂可以是C(选填序号,下同),现象是产生白色沉淀,则证明气体产物中含有SO3; 装置Ⅳ中的试剂可以是BE.
A.2mol/LNa2CO3溶液 B.品红溶液
C.0.5mol/L BaCl2溶液 D.0.5mol/LBa(NO3)2
E.0.01mol/L KMnO4溶液 F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为SO2+2OH-=SO32-+H2O.
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
⑤若用22.8g FeSO4固体做实验,完全分解后,得到11.2g固体,其中Fe2O3的质量分数=35.7%
(精确到0.1%)
 硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.(1)新制的绿矾(FeSO4•7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:4FeSO4•7H2O+O2=4Fe(OH)SO4+26H2O.
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃.
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”.
上述装置Ⅲ和Ⅳ用来检验气体产物.试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在50℃(选填“0℃、25℃、50℃”),装置Ⅱ的作用是防止产生倒吸.
②装置Ⅲ中的试剂可以是C(选填序号,下同),现象是产生白色沉淀,则证明气体产物中含有SO3; 装置Ⅳ中的试剂可以是BE.
A.2mol/LNa2CO3溶液 B.品红溶液
C.0.5mol/L BaCl2溶液 D.0.5mol/LBa(NO3)2
E.0.01mol/L KMnO4溶液 F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为SO2+2OH-=SO32-+H2O.
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入KSCN溶液 , | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 固体中含有FeO |
(精确到0.1%)
6.下列气态氢化物中最稳定的是( )
| A. | H2O | B. | PH3 | C. | HF | D. | NH3 |