题目内容
18.氯化铁的水溶液呈酸(填“酸”,“中”,“碱”)性,原因是(用离子方程式表示)Fe3++3H2O?Fe(OH)3+3H+.把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是Fe2O3.常温下在0.10mol•L-1,FeCl3溶液中加入氢氧化钠稀充分搅拌有红褐色氢氧化铁沉淀生成,当溶液的pH=5时,c(Fe3+)=4.0×10-11mol•L-1.(已知常温下,Ksp[Fe(OH)3]=4.0×10-38)分析 氯化铁水溶液中,铁离子发生水解反应溶液显酸性,把FeCl3溶液蒸干水解生成的氯化氢挥发,灼烧,最后得到的主要固体产物是氢氧化铁分解产物,如果要从氯化铁溶液得到纯氯化铁固体,需要抑制氯化铁的水解得到氯化铁;根据Ksp来计算;
解答 解:氯化铁水溶液中,铁离子发生水解反应溶液显酸性,反应的离子方程式为Fe3++3H2O?Fe(OH)3+3H+,把FeCl3溶液蒸干水解生成的氯化氢挥发,灼烧,最后得到的主要固体产物是氢氧化铁分解产物为Fe2O3;
当溶液的pH=5时,即溶液中的c(OH-)=10-9mol/L,由于常温下,Ksp[Fe(OH)3]=4.0×10-38,则有:c(OH-)3•c(Fe3+)=4.0×10-38,即(10-9)3•c(Fe3+)=4.0×10-38,可解得c(Fe3+)=4.0×10-11mol/L.
故答案为:酸;Fe3++3H2O?Fe(OH)3+3H+;Fe2O3;4.0×10-11,
点评 本题考查了盐类水解的应用和Ksp的有关计算,影响水解平衡的因素的理解应用,掌握基础是关键,题目较简单.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
9. 甲、乙、丙、丁四种物质中,丁为难溶于水的物质,在一定条件下,它们之间具有如图转化关系(部分反应物、生成物和反应条件未列出).下列有关物质的推断不正确的是( )
甲、乙、丙、丁四种物质中,丁为难溶于水的物质,在一定条件下,它们之间具有如图转化关系(部分反应物、生成物和反应条件未列出).下列有关物质的推断不正确的是( )
 甲、乙、丙、丁四种物质中,丁为难溶于水的物质,在一定条件下,它们之间具有如图转化关系(部分反应物、生成物和反应条件未列出).下列有关物质的推断不正确的是( )
甲、乙、丙、丁四种物质中,丁为难溶于水的物质,在一定条件下,它们之间具有如图转化关系(部分反应物、生成物和反应条件未列出).下列有关物质的推断不正确的是( )| A. | 若甲为C,则Y可能是Ba(OH)2溶液 | B. | 若甲为CO2,则Y可能是FeCl3溶液 | ||
| C. | 若甲为NH3,则Y可能是NaOH | D. | 若甲为S,则Y可能是BaC12溶液 |
6.下列说法不正确的是( )
| A. | 干冰中分子的堆积方式为非密堆积 | |
| B. | 金属晶体中原子的最大配位数为12 | |
| C. | 晶体硅熔化时需破坏非极性共价键 | |
| D. | 冰融化为水的过程中其密度先变大,超过4℃后又逐渐变小 |
13.足量下列溶液与相同质量的铝反应放出氢气,消耗溶质物质的量最少的是( )
| A. | NaOH溶液 | B. | 稀硫酸 | C. | 盐酸 | D. | Ba(OH)2溶液 |
3.测定CuSO4•xH2O晶体的x值,数据如表中所示,已知x的理论值为5.0,产生误差的可能原因是( )
| 坩埚质量 | 坩埚+试样 | 失水后,坩埚+试样 |
| 11.70g | 20.82g | 16.50g |
| A. | 晶体中含不挥发杂质 | B. | 未做恒重操作 | ||
| C. | 加热前晶体未研磨 | D. | 加热时有晶体溅出 |
10.已知298K时,CO2(g)的△H为-393.5kJ•mol-1,H2O(l)的△H=-285.8kJ•mol-1,乙炔的燃烧热为-1300kJ•mol-1,则乙炔的标准生成热为( )
| A. | 227.2kJ•mol-1 | B. | -227.2kJ•mol-1 | C. | 798.8kJ•mol-1 | D. | -798.8kJ•mol-1 |
7.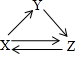 X、Y、Z三种物质存在如图所示的转化关系(图中“→”表示一步转化).下列各组物质中,不能满足此转化关系的是( )
X、Y、Z三种物质存在如图所示的转化关系(图中“→”表示一步转化).下列各组物质中,不能满足此转化关系的是( )
 X、Y、Z三种物质存在如图所示的转化关系(图中“→”表示一步转化).下列各组物质中,不能满足此转化关系的是( )
X、Y、Z三种物质存在如图所示的转化关系(图中“→”表示一步转化).下列各组物质中,不能满足此转化关系的是( )| 物质 选项 | X | Y | Z |
| A | Al | Al2O3 | Na[Al(OH)4](或NaAlO2) |
| B | Fe | FeCl3 | FeCl2 |
| C | C | CO | CO2 |
| D | Cl2 | HCl | NaCl |
| A. | A | B. | B | C. | C | D. | D |
16.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,15g甲基(-CH3)所含的中子数为6NA | |
| B. | a gO2和O3的混合气体中含有的分子总数为$\frac{a{N}_{A}}{32}$ | |
| C. | 在1L的碳酸钠溶液中,若c(CO32-)=1mol•L-1,则Na+个数为2NA | |
| D. | 78g过氧化钠晶体中,含2NA个阴离子 |