题目内容
下列描述或应用中,正确的是( )
| A、常温常压下,28g N2和CO的混合气体体积为22.4L | ||
| B、任何物质的摩尔质量等于它的相对原子质量或相对分子质量 | ||
C、一个钠原子的质量约为
| ||
| D、CO2的摩尔质量为44g |
考点:物质的量的相关计算
专题:计算题
分析:A.常温常压下,气体的Vm≠22.4L/mol;
B.摩尔质量与相对原子质量或相对分子质量单位不同;
C.根据n=
=
计算;
D.单位应为g/mol.
B.摩尔质量与相对原子质量或相对分子质量单位不同;
C.根据n=
| m |
| M |
| N |
| N |
D.单位应为g/mol.
解答:
解:A.28g N2和CO的混合气体的物质的量为1mol,但常温常压下,气体的Vm≠22.4L/mol,则体积不等于22.4L,故A错误;
B.摩尔质量与相对原子质量或相对分子质量单位不同,故B错误;
C.1molNa的质量为23g,原子个数为6.02×1023,则一个钠原子的质量约为
g,故C正确;
D.CO2的摩尔质量为44g/mol,故D错误.
故选C.
B.摩尔质量与相对原子质量或相对分子质量单位不同,故B错误;
C.1molNa的质量为23g,原子个数为6.02×1023,则一个钠原子的质量约为
| 23 |
| 6.02×1023 |
D.CO2的摩尔质量为44g/mol,故D错误.
故选C.
点评:本题考查物质的量的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,难度不大,注意相关计算公式、单位以及概念的理解和运用.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、Fe3O4与稀硝酸反应:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B、SO2通入Ba(NO3)2溶液中:Ba2++SO2+H2O=BaSO3↓+2H+ |
| C、硫酸铵溶液与Ba(OH)2溶液反应:Ba2++SO42-=BaSO4↓ |
| D、FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 |
下列溶液中,阴离子浓度最大的是( )
| A、0.5mol/L HCl溶液50mL |
| B、0.6mol/L Al2(SO4)3溶液40mL |
| C、0.7mol/L NaCl溶液70mL |
| D、0.8mol/L Na2CO3溶液60mL |
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共2.88g,经如下处理:下列说法正确的是( )


| A、滤液A中的阳离子为Fe2+、Fe3+、H+ |
| B、V=224 |
| C、样品中CuO的质量为2.0g |
| D、样品中Fe元素的质量为1.07g |
关于下列各装置图的叙述中,不正确的是( )
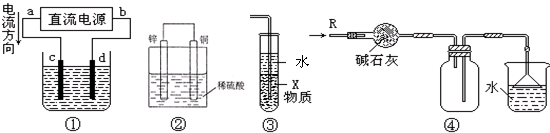

| A、若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
| B、装置②是原电池,能将化学能转化为电能,锌电极发生氧化反应 |
| C、装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
| D、装置④可用于干燥、收集氨气,并吸收多余的氨气 |
分子式为C6H12O2的有机物A,有香味.A在酸性条件下水解生成有机物B和C.B能和碳酸氢钠溶液反应生成气体;C不能发生消去反应生,能催化氧化生成醛或酮.则A可能的结构有几种( )
| A、1 | B、3 | C、5 | D、多于5种 |
将过量Cl2通入NaBr和NaI的混合液中,然后把混合溶液蒸干,再将剩余残渣灼烧,最后留下的物质( )
| A、NaBr,NaI |
| B、NaCl,NaBr |
| C、NaCl |
| D、NaCl,I2 |
 某离子反应中涉及N2、H2O、ClO-、H+、NH4+、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图.
某离子反应中涉及N2、H2O、ClO-、H+、NH4+、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图.