题目内容
在常温下,发生下列几种反应:①16H++10Z一+2XO4一=2X2++5Z2+8H2O ②2A2++B2=2A3++2B一 ③2B一+Z2=B2+2Z根据上述反应,判断下列结论中错误的是( )
| A、氧化性强弱的顺序为:XO4一>Z2>B2>A3+ |
| B、Z2在①、③反应中为还原剂 |
| C、溶液中可发生:Z2+2A2+=2A3++2Z一 |
| D、X2十是XO4一的氧化产物 |
考点:氧化性、还原性强弱的比较
专题:
分析:A、利用氧化剂的氧化性大于氧化产物的氧化性来分析;
B、利用Z元素的化合价升高时作还原剂,化合价降低时为氧化剂;
C、根据化合价判断氧化剂,利用氧化剂的氧化性大于氧化产物的氧化性,进一步判断反应能否发生;
D、利用反应①可知X元素的化合价降低来分析.
B、利用Z元素的化合价升高时作还原剂,化合价降低时为氧化剂;
C、根据化合价判断氧化剂,利用氧化剂的氧化性大于氧化产物的氧化性,进一步判断反应能否发生;
D、利用反应①可知X元素的化合价降低来分析.
解答:
解:A、①中X的化合价降低,则氧化性XO4->Z2,②中B元素的化合价降低,则氧化性B2>A3+,③中Z元素的化合价降低,则氧化性Z2>B2,则氧化性XO4->Z2>B2>A3+,故A正确;
B、①中Z元素的化合价升高,则Z2为氧化产物,③中Z元素的化合价降低,则Z2为氧化剂,故B错误;
C、①中X的化合价降低,则氧化性XO4->Z2,②中B元素的化合价降低,则氧化性B2>A3+,③中Z元素的化合价降低,则氧化性Z2>B2,则氧化性Z2>A3+,反应Z2+2A2+=2A3++2Z-可发生,故C正确;
D、反应①中X元素的化合价降低,则XO4-为氧化剂,则X2+是XO4-的还原产物,故D错误;
故选BD.
B、①中Z元素的化合价升高,则Z2为氧化产物,③中Z元素的化合价降低,则Z2为氧化剂,故B错误;
C、①中X的化合价降低,则氧化性XO4->Z2,②中B元素的化合价降低,则氧化性B2>A3+,③中Z元素的化合价降低,则氧化性Z2>B2,则氧化性Z2>A3+,反应Z2+2A2+=2A3++2Z-可发生,故C正确;
D、反应①中X元素的化合价降低,则XO4-为氧化剂,则X2+是XO4-的还原产物,故D错误;
故选BD.
点评:本题考查氧化还原反应中氧化性的比较及相关的基本概念,明确反应中元素的化合价变化及是氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性解答的关键.

练习册系列答案
相关题目
 某有机物是药物生产的中间体,其结构简式如图.下列有关叙述不正确的是( )
某有机物是药物生产的中间体,其结构简式如图.下列有关叙述不正确的是( )| A、该有机物与浓溴水可发生取代反应 |
| B、该有机物与浓硫酸混合共热可发生消去反应 |
| C、1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH |
| D、该有机物经催化氧化后与新制氢氧化铜悬浊液共热生成砖红色沉淀 |
 2013年,我国部分地区发生了禽流感.我国科学家发现金丝桃素对高致病性禽流感病毒杀灭效果良好,某种金丝桃素的结构式如图所示,下列是有关金丝桃素说法:其中错误的是( )
2013年,我国部分地区发生了禽流感.我国科学家发现金丝桃素对高致病性禽流感病毒杀灭效果良好,某种金丝桃素的结构式如图所示,下列是有关金丝桃素说法:其中错误的是( )①属于烃的衍生物,燃烧只产生CO2和H2O
②可以发生取代、加成、酯化、消去等反应
③分子式为C17H23NO3,苯环上的一氯取代物有3种
④1mol该物质最多能和6mol H2发生加成反应.
| A、①和④ | B、②和③ |
| C、①和③ | D、②和④ |
一定温度下,在容积不变的密闭容器中,反应A(g)+3B(g)?2C(g)达到平衡的标志是( )
| A、ν正(A)=3 ν逆(B) |
| B、单位时间内生成n molA,同时生成3n molB |
| C、容器内混合气体的平均相对分子质量不变 |
| D、容器内混合气体的密度不随时间而改变 |
下列有关微粒半径大小的比较中,正确的是( )
| A、Na+>F- |
| B、Fe<Fe2+ |
| C、Cl<Cl- |
| D、K+<Ca2+ |
关于下列四个装置的说明符合实验要求的是( )


| A、装置①:实验室中若需制备较多量的乙炔可用此装置 |
| B、装置②:实验室中可用此装置来制备硝基苯,但产物中可能会混有苯磺酸 |
| C、装置③:实验室中可用此装置来分离含碘的四氯化碳液体,最终在锥型瓶中可获得碘 |
| D、装置④:实验室中可用此装置来制备乙酸乙酯并在烧瓶中获得产物 |
下列说法中,正确的是( )
| A、CO2的摩尔质量为44 g |
| B、1 mol N2的质量是14 g |
| C、等质量的水与质量分数98%L的硫酸混合所得溶液的质量分数大于49% |
| D、标准状况下,1 mol CO2所占的体积约是22.4 L |
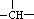 ,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构)
,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构)