题目内容
12.引燃密闭恒容容器中的己烷和氧气的混合气体,使其进行不完全燃烧,在120℃时测得反应前后气体的压强分别为0.36×105 Pa和0.52×105 Pa,这一燃烧反应中主要发生的化学反应方程式是( )| A. | C6H14+9O2→CO+5CO2+7H2O | B. | C6H14+7O2→5CO+CO2+7H2O | ||
| C. | C6H14+8O2→3CO+3CO2+7H2O | D. | 2C6H14+15O2→8CO+4CO2+14H2O |
分析 根据 pV=nRT,等温定容条件下,P与n 成正比关系;因此,压强之比是 9:13,那么气体的物质的量之比也是 9:13,再根据方程式中计量数分析.
解答 解:在120℃时测得反应前后气体的压强分别为0.36×105帕和0.52×105 帕,根据 pV=nRT,等温定容条件下,P与n 成正比关系;因此压强之比是 9:13,那么气体的物质的量之比也是 9:13,因此反应前后计量数之比为9:13;再根据方程式中计量数可知,故C正确;
故选C.
点评 本题考查了压强与气体物质的量的关系,要注意120°C,水是气态,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
2.将一定质量的镁铜合金加入到100mL某浓度HNO3溶液中,两者恰好反应,假设反应的还原产物只有NO气体,向所得溶液中加入物质的量浓度为3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是( )
| A. | 加入合金的质量不可能为6.6g | |
| B. | 参加反应的硝酸的物质的量浓度为1mol/L | |
| C. | 生成沉淀完全时消耗NaOH溶液的体积为100 mL | |
| D. | 生成NO气体体积为2.24 L |
20.比较、推理是化学学习常用的方法,以下是根据一些反应事实推导出的影响化学反应的因素,其中推导不合理的是( )
| 序号 | 化学反应事实 | 影响化学反应因素 |
| A | 铁丝在空气中很难燃烧,而在氧气中能剧烈燃烧 | 反应物浓度 |
| B | 碳在常温下不与氧气发生反应,而在高温时能与氧气反应 | 反应温度 |
| C | 水在通电的条件才能分解,双氧水只要加入二氧化锰就迅速分解 | 催化剂 |
| D | 铜片在空气中很难燃烧,纳米铜粉在空气中较易燃烧 | 反应物的接触面积 |
| A. | A | B. | B | C. | C | D. | D |
7.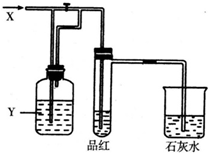 如图所示是一套检验气体性质的实验装置.向装置中缓慢加入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红褪色.据此判断气体X和洗气瓶内溶液Y分别可能为( )
如图所示是一套检验气体性质的实验装置.向装置中缓慢加入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红褪色.据此判断气体X和洗气瓶内溶液Y分别可能为( )
 如图所示是一套检验气体性质的实验装置.向装置中缓慢加入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红褪色.据此判断气体X和洗气瓶内溶液Y分别可能为( )
如图所示是一套检验气体性质的实验装置.向装置中缓慢加入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红褪色.据此判断气体X和洗气瓶内溶液Y分别可能为( )| ① | ② | ③ | ④ | |
| X | SO2 | H2S | CO2 | Cl2 |
| Y | 饱和的NaHCO3溶液 | 浓硫酸 | Na2SO3溶液 | Na2CO3溶液 |
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |
17.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向NaAlO2溶液通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+2I-+8H+═3Fe2++I2+4H2O | |
| C. | 用FeS除去工业废水中的Hg2+:Hg2++S2-═HgS↓ | |
| D. | 向饱和的Ca(OH)2溶液中滴加过量NaHCO3溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O |
4.电子计算器中所用纽扣式电池为银锌电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-═Zn(OH)2,Ag2O+H2O+2e-═2Ag+2OH-,总反应式为Ag2O+H2O+Zn═Zn(OH)2+2Ag.下列叙述不正确的是( )
| A. | 电子由锌经外电路流向氧化银 | |
| B. | 该电池可实现化学能和电能的相互转化 | |
| C. | 锌是负极,氧化银是正极 | |
| D. | 工作时,负极区溶液pH减小,正极区pH增大 |
1.如图是关于反应aA2(g)+bB2(g)?cC(g)△H<0 的平衡移动图象,影响平衡移动的原因可能是( )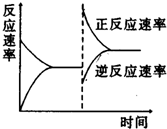

| A. | 升高温度,同时加压 | |
| B. | 降低温度,同时减压 | |
| C. | 增大反应物浓度,同时减小生成物浓度 | |
| D. | 增大反应物浓度,同时升高温度 |
 .
.