题目内容
3.A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F最外层电子数的2倍,C和D的最外层电子数之和为11.请回答下列问题:(1)以上元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式)SiH4,E、F、L所形成的简单离子的半径由大到小的顺序为(用离子符号表示)S2->Na+>Al3+.
(2)由L、I两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为
 .
.(3)固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生,写出该反应的离子方程式Na2O2+S2-+2H2O=S↓+2Na++4OH-.
(4)由A、B、C、D按原子个数比4:1:1:2形成一种化合物Y,则Y的化学式为(NH4)2C2O4 ,向Y中加足量稀硫酸后,再加高锰酸钾溶液,可使酸性高锰酸钾溶液褪色,写出使酸性高锰酸钾溶液褪色的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
分析 A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,则A为氢元素;A与E同一主族,E原子序数比A至少大4,可推知E为Na;B、C、D为同一周期,应处于第二周期,E、F、G、L、I都处于第三周期,令F的最外层电子数为x,其质子数为10+x,则D原子最外层电子数为2x,质子数为2+2x,由于F的质子数比D多5,则有:10+x-(2-2x)=5,解得x=3,故F为Al、D为O,C的原子序数=28-8-13=7,则C为N;D与L为同主族,则L为S,可推知I是Cl,B与G同主族,结合原子序数可知,处于ⅣA族,故B为C、G为Si,据此解答.
解答 解:A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,则A为氢元素;A与E同一主族,E原子序数比A至少大4,可推知E为Na;B、C、D为同一周期,应处于第二周期,E、F、G、L、I都处于第三周期,令F的最外层电子数为x,其质子数为10+x,则D原子最外层电子数为2x,质子数为2+2x,由于F的质子数比D多5,则有:10+x-(2-2x)=5,解得x=3,故F为Al、D为O,C的原子序数=28-8-13=7,则C为N;D与L为同主族,则L为S,可推知I是Cl,B与G同主族,结合原子序数可知,处于ⅣA族,故B为C、G为Si.
(1)非金属元素中,Si的非金属性最弱,则所形成的最简单气态氢化物稳定性最弱的是SiH4,电子层越多离子半径越大,相同电子排布的离子中原子序数大的离子半径小,则E、F、L所形成的简单离子的半径由大到小的顺序为S2->Na+>Al3+,
故答案为:SiH4;S2->Na+>Al3+;
(2)L、I两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,化合物为S2Cl2,其电子式为 ,
,
故答案为: ;
;
(3)化合物Na2O2投入到化合物Na2S的水溶液,生成沉淀为S,同时生成NaOH,反应离子方程式为:Na2O2+S2-+2H2O=S↓+2Na++4OH-,
故答案为:Na2O2+S2-+2H2O=S↓+2Na++4OH-;
(4)由H、C、N、O按原子个数比4:1:1:2形成一种化合物Y为(NH4)2C2O4 ,向Y中加足量稀硫酸后,再加高锰酸钾溶液,可使酸性高锰酸钾溶液褪色,使酸性高锰酸钾溶液褪色的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:(NH4)2C2O4 ;2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
点评 本题考查位置结构性质的关系及应用,根据原子结构、元素的位置推断元素为解答的关键,侧重对基础知识的考查,注意对元素化合物性质的掌握,(4)为易错点,学生容易忽略草酸盐,题目难度中等.

| A. | Fe2+、CH3COO-、Na+、SO42 | B. | K+、Ca2+、HCO3-、Cl- | ||
| C. | Al3+、NH4+、Cl-、NO2 | D. | K+、Na+、SiO32、AlO2- |
| A. | 2 mol•L-1 | B. | 3.36 mol•L-1 | ||
| C. | 1.5 mol•L-1 | D. | 缺少数据,无法计算 |
| A. | 容量瓶内有水,未经过干燥处理 | |
| B. | 定容时,仰视刻度线 | |
| C. | 用量筒量取浓NaOH溶液时,用水洗涤量筒2~3次,洗涤液倒入烧杯中 | |
| D. | 定容后倒转容量瓶几次,发现液体最低点低于刻度线,再补加几滴水到刻度线 |
| A. | 久置在空气中的NaOH溶液,加盐酸时有气体产生 | |
| B. | 50 mL 12 mol•L-1的浓盐酸与足量的MnO2反应,生成0.15 mol Cl2 | |
| C. | 在常温下,浓H2SO4不与Cu反应,是因为铜被钝化 | |
| D. | CO2通入浓的CaCl2溶液中产生白色沉淀 |
| A. | C6H14+9O2→CO+5CO2+7H2O | B. | C6H14+7O2→5CO+CO2+7H2O | ||
| C. | C6H14+8O2→3CO+3CO2+7H2O | D. | 2C6H14+15O2→8CO+4CO2+14H2O |
| A. | 能溶解Al2O3的溶液:Na+、K+、HCO${\;}_{3}^{-}$、NO${\;}_{3}^{-}$ | |
| B. | 0.1mol•L-1Ca(ClO)2溶液:K+、Na+、I-、Cl- | |
| C. | 能使石蕊显红色的溶液:K+、Fe2+、Cl-、NO${\;}_{3}^{-}$ | |
| D. | 加入KSCN显红色的溶液:Na+、Mg2+、Cl-、SO${\;}_{4}^{2-}$ |

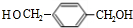 .上述反应中属于取代反应的是①②(填数字序号).
.上述反应中属于取代反应的是①②(填数字序号). +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$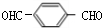 +2H2O.
+2H2O. .
.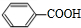 .
.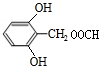 或
或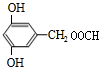 (写出一种).
(写出一种).