题目内容
 纯钛烤瓷牙是近几年才发展成熟的金属烤瓷技术,过氧硫酸被用于假牙的消毒.过氧硫酸可由氯磺酸通过反应I制得,氯磺酸结构如图1.
纯钛烤瓷牙是近几年才发展成熟的金属烤瓷技术,过氧硫酸被用于假牙的消毒.过氧硫酸可由氯磺酸通过反应I制得,氯磺酸结构如图1.反应I:H2O2+ClSO2OH?H2SO5+HCl
(1)钛的价电子排布式为
(2)电离能:I1(Ti)
(3)反应I断裂的共价键类型为
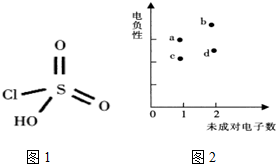
(4)反应I涉及元素的原子核外未成对电子数与元素电负性的关系如图2,其原子序数从小到大的顺序为
(5)过氧硫酸的结构式为
考点:原子核外电子排布,元素电离能、电负性的含义及应用,化学键,原子轨道杂化方式及杂化类型判断
专题:物质的组成专题,化学键与晶体结构
分析:(1)Ti是22号元素,根据核外电子排布规律书写价电子排布式;
(2)电子排布为全充满时,能量低较稳定,不容易失去电子;
(3)根据反应物中的化学键判断;
(4)同周期从左到右电负性依次增强,同主族从上到下电负性依次减弱;
(5)根据H、O、S的最外层电子数及能形成的共价键分析;根据过氧硫酸的结构式分析分子中成键电子对数;根据过氧硫酸的结构式中O与S形成的共价键数判断.
(2)电子排布为全充满时,能量低较稳定,不容易失去电子;
(3)根据反应物中的化学键判断;
(4)同周期从左到右电负性依次增强,同主族从上到下电负性依次减弱;
(5)根据H、O、S的最外层电子数及能形成的共价键分析;根据过氧硫酸的结构式分析分子中成键电子对数;根据过氧硫酸的结构式中O与S形成的共价键数判断.
解答:
解:(1)Ti是22号元素,核外电子排布式为1s22s22p63s23p63d24s2,价电子排布式为为3d24s2;
故答案为:3d24s2;Ti3+;
(2)电子排布为全充满时,能量低较稳定,不容易失去电子;钛的价电子排布式为3d24s2,钾的价电子排布式为4s1,所以钛比钾更难失去1个电子,即第一电离能钛大于钾;
故答案为:>;
(3)过氧硫酸可由氯磺酸通过反应I制得,反应I:H2O2+ClSO2OH?H2SO5+HCl,已知氯磺酸结构中全部为极性键,反应中断裂的是Cl-S键和过氧化氢中的O-H键,所以断裂的全部是极性键;
故答案为:极性键;
(4)同周期从左到右电负性依次增强,同主族从上到下电负性依次减弱;反应I:H2O2+ClSO2OH?H2SO5+HCl中H、O、S、Cl四种元素,H、Cl含有一个未成对电子,电负性Cl大于H,O、S含有2个未成对电子,电负性O大于S,则a为Cl,b为O,c为H,d为S,所以原子序数从小到大的顺序为c、b、d、a;
故答案为:c、b、d、a;
(5)H最外层含有1个电子,能形成1个共价键,O最外层含有6个电子,能形成2个共价键,S最外层含有6个电子,能形成2个或6个共价键,则过氧硫酸的结构式为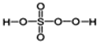 ;已知过氧硫酸的结构式为
;已知过氧硫酸的结构式为 ,S原子形成4对成键电子对,所以中心硫原子的轨道杂化类型为sp3;已知过氧硫酸的结构式为
,S原子形成4对成键电子对,所以中心硫原子的轨道杂化类型为sp3;已知过氧硫酸的结构式为 ,O与S之间形成6对共用电子对,S的吸引电子能力比O弱,电子对偏离S,所以S为+6价;
,O与S之间形成6对共用电子对,S的吸引电子能力比O弱,电子对偏离S,所以S为+6价;
故答案为: ;sp3;+6.
;sp3;+6.
故答案为:3d24s2;Ti3+;
(2)电子排布为全充满时,能量低较稳定,不容易失去电子;钛的价电子排布式为3d24s2,钾的价电子排布式为4s1,所以钛比钾更难失去1个电子,即第一电离能钛大于钾;
故答案为:>;
(3)过氧硫酸可由氯磺酸通过反应I制得,反应I:H2O2+ClSO2OH?H2SO5+HCl,已知氯磺酸结构中全部为极性键,反应中断裂的是Cl-S键和过氧化氢中的O-H键,所以断裂的全部是极性键;
故答案为:极性键;
(4)同周期从左到右电负性依次增强,同主族从上到下电负性依次减弱;反应I:H2O2+ClSO2OH?H2SO5+HCl中H、O、S、Cl四种元素,H、Cl含有一个未成对电子,电负性Cl大于H,O、S含有2个未成对电子,电负性O大于S,则a为Cl,b为O,c为H,d为S,所以原子序数从小到大的顺序为c、b、d、a;
故答案为:c、b、d、a;
(5)H最外层含有1个电子,能形成1个共价键,O最外层含有6个电子,能形成2个共价键,S最外层含有6个电子,能形成2个或6个共价键,则过氧硫酸的结构式为
 ;已知过氧硫酸的结构式为
;已知过氧硫酸的结构式为 ,S原子形成4对成键电子对,所以中心硫原子的轨道杂化类型为sp3;已知过氧硫酸的结构式为
,S原子形成4对成键电子对,所以中心硫原子的轨道杂化类型为sp3;已知过氧硫酸的结构式为 ,O与S之间形成6对共用电子对,S的吸引电子能力比O弱,电子对偏离S,所以S为+6价;
,O与S之间形成6对共用电子对,S的吸引电子能力比O弱,电子对偏离S,所以S为+6价;故答案为:
 ;sp3;+6.
;sp3;+6.
点评:本题考查了电子排布式、第一电离能、化学键、电负性等知识点,题目综合性较强,难度中等,侧重于考查学生对知识的综合应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列物质性质变化规律正确的是( )
| A、O、F、H的原子半径依次减小 |
| B、HI、HBr、HCl、HF的沸点依次降低 |
| C、干冰、钠、冰的熔点依次降低 |
| D、金属Na、Mg、Al的硬度依次降低 |
在下列给定的溶液中,一定能大量共存的离子组是( )
| A、过量Al与NaOH溶液反应所得溶液中:K+、Cl-、Al3+、SO42- | ||
| B、常温下,OH-的浓度为10-11mol/L的溶液中:Na+、I-、NH4+、NO3- | ||
C、常温下,
| ||
| D、与Al反应产生H2的溶液中:K+、Na+、Cl-、NO3- |
下列现象与电化学腐蚀无关的是( )
| A、黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B、生铁比软铁心(几乎是纯铁)容易生锈 |
| C、铁制器件附有铜质配件,在接触处易生锈 |
| D、铁丝在纯氧气中燃烧 |
下列说法中正确的是(NA表示阿伏加德罗常数的值)( )
| A、常温常压下,28g氮气所含有的原子数目为NA |
| B、1molNa被完全氧化生成Na2O2,失去电子数目为NA |
| C、标准状况下,22.4L水中含有NA个水分子 |
| D、1mol/L的CaCl2溶液中含有的Cl-数目为2NA |
 A、B、C、D、E是原子序数依次增大的五种元素.B元素原子最外层电子数比内层多3个,C、D元素同主族且原子序数D为C的二倍,E元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,回答下列问题.
A、B、C、D、E是原子序数依次增大的五种元素.B元素原子最外层电子数比内层多3个,C、D元素同主族且原子序数D为C的二倍,E元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,回答下列问题.
 Ⅰ、(将2mol SO2和1mol O2气体在1L的容器中混合,在一定条件下发生如下反应:2SO2(g)+O2 (g) 2SO3 (g).若经过2s后测得SO3的浓度为0.6mol/L.试计算:(1)O2的化学反应速率V(O2)=
Ⅰ、(将2mol SO2和1mol O2气体在1L的容器中混合,在一定条件下发生如下反应:2SO2(g)+O2 (g) 2SO3 (g).若经过2s后测得SO3的浓度为0.6mol/L.试计算:(1)O2的化学反应速率V(O2)=