题目内容
3.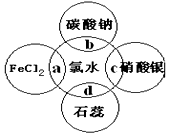 氯水中有多种成分,因而具有多重性质,根据氯水分别与如图四种物质发生的反应,填空a、b、c、d重合部分代表物质间反应,且氯水足量)
氯水中有多种成分,因而具有多重性质,根据氯水分别与如图四种物质发生的反应,填空a、b、c、d重合部分代表物质间反应,且氯水足量)(1)能证明氯水具有漂白性的是d(填“a”、“b”、“c”或“d”).
(2)c过程中的现象是产生白色沉淀,
(3)c中的离子方程式为Cl-+Ag+=AgCl↓,
(4)氯气是一种有毒气体,如何处理尾气(用离子方程式表示)为2OH-+Cl2=Cl-+ClO-+H2O.
分析 氯气与水反应生成盐酸和次氯酸,氯水中含有:H2O、HClO、Cl2、Cl-、ClO-,H+、OH-,依据各种离子的性质解答.
解答 解:(1)氯水中含有氢离子,遇到石蕊显红色,又因为含有次氯酸,次氯酸具有漂白性,溶液最后褪色;
故答案为:d;
(2)氯水中含有氯离子,氯离子与银离子发生反应生成氯化银沉淀;
故答案为:产生白色沉淀;
(3)氯水中含有氯离子,氯离子与银离子发生反应生成氯化银沉淀,离子方程式为:Cl-+Ag+=AgCl↓,
故答案为:Cl-+Ag+=AgCl↓;
(4)处理尾气是氢氧化钠与氯气反应生成氯化钠和次氯酸钠,离子方程式表示为:2OH-+Cl2=Cl-+ClO-+H2O,
故答案为:2OH-+Cl2=Cl-+ClO-+H2O.
点评 本题考查了氯水的性质,注意掌握氯气与水发生的反应,明确氯水中所含粒子是解题关键,题目难度不大.

练习册系列答案
相关题目
13.联氨可用作火箭燃料,其电子式为 ,则N元素的化合价为( )
,则N元素的化合价为( )
 ,则N元素的化合价为( )
,则N元素的化合价为( )| A. | -3 | B. | -2 | C. | 0 | D. | +5 |
14.与100mL 0.4mol•L-1NH4NO3溶液中的NO3-浓度相同的是( )
| A. | 400 mL 0.1 mol•L-1的KNO3溶液 | B. | 100 mL 0.4 mol•L-1的Ba(NO3)2溶液 | ||
| C. | 100 mL 0.2 mol•L-1的Mg(NO3)2溶液 | D. | 200 mL 0.1mol•L-1的Fe(NO3)3溶液 |
18.下列关于有机化合物的说法正确的是( )
| A. | 以淀粉为原料可制取乙酸乙酯 | B. | 聚氯乙烯分子中含碳碳双键 | ||
| C. | 丁烷有3种同分异构体 | D. | 油脂的皂化反应属于加成反应 |
8.下列叙述正确的是( )
| A. | 用冰冷却苯,苯可以凝结成无色的晶体 | |
| B. | 苯与溴水混合后因发生反应而使溴水褪色 | |
| C. | 在苯中加入酸性 KMnO4 溶液,振荡后静置,上层液体为紫红色 | |
| D. | 1 mol 苯能与 3 mol H2发生加成反应,说明在苯环中含有 3 个双键 |
15.用NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 9.2g甲苯和丙三醇的混合物中,含氢原子数目为0.8NA | |
| C. | 用惰性电极电解1L浓度均为0.2mol/L的Cu(NO3)2和AgNO3的混合溶液,当有0.2NA个电子转移时,理论上阴极析出6.4g金属 | |
| D. | 电解精炼铜(粗铜含铁、锌、银、金杂质)时,每转移2NA个电子,阴极析出1 mol Cu |
12.下列物质中分子间能形成氢键的是( )
| A. | HBr | B. | H2S | C. | NH3 | D. | PH3 |
13.乙烷混有乙烯,欲除去乙烯得到纯净干燥的乙烷,下列方法正确的( )
| A. | 依次通过溴水、烧碱、浓硫酸 | B. | 依次通过酸性KMnO4溶液、浓硫酸 | ||
| C. | 依次通过澄清石灰水、浓硫酸 | D. | 通入氢气,在一定条件下反应 |