题目内容
用MnO2制KMnO4的工艺流程如图:电解池中两极材料均为碳棒,在水或酸性溶液中K2MnO4发生歧化而变成MnO2和KMnO4.
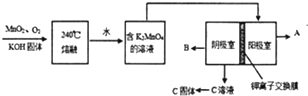
①写出240℃熔融时发生反应的化学方程式 ,投料时必须满足n(KOH):n(MnO2) .
②阳极的电极反应为 .
③B物质是 (填化学式),可以循环使用的物质是 (填化学式).

①写出240℃熔融时发生反应的化学方程式
②阳极的电极反应为
③B物质是
考点:电解原理,制备实验方案的设计
专题:实验设计题,元素及其化合物
分析:用MnO2制KMnO4的工艺流程:二氧化锰、氢氧化钾以及氧气在240℃下反应可以得到锰酸钾,氢氧化钾、氧气过量,可以保证锰元素的全部转化,将得到的高锰酸钾溶于水,可以得到高锰酸钾的水溶液,对其进行电解,获得较大浓度的高锰酸钾溶液
①根据流程中的反应物和产物结合化学方程式的书写来回答,为保证锰元素的利用率,应该保证一方过量;
②在电解池的阳极上发生失电子的氧化反应;
③根据反应确定得到的物质以及可以循环使用的物质.
①根据流程中的反应物和产物结合化学方程式的书写来回答,为保证锰元素的利用率,应该保证一方过量;
②在电解池的阳极上发生失电子的氧化反应;
③根据反应确定得到的物质以及可以循环使用的物质.
解答:
解:用MnO2制KMnO4的工艺流程:二氧化锰、氢氧化钾以及氧气在240℃下反应可以得到锰酸钾,氢氧化钾、氧气过量,可以保证锰元素的全部转化,将得到的高锰酸钾溶于水,可以得到高锰酸钾的水溶液,对其进行电解,获得较大浓度的高锰酸钾溶液,
①240℃熔融时发生反应的化学方程式为:2MnO2+O2+4KOH
2K2MnO4+2H2O,氢氧化钾、氧气过量,可以保证锰元素的全部转化,投料时必须满足n(KOH):n(MnO2)大于2:1,
故答案为:2MnO2+O2+4KOH
2K2MnO4+2H2O;大于2:1;
②在电解池的阳极上是锰酸钾中的阴离子失电子的过程,即MnO42--e-=MnO4-,
故答案为:MnO42--e-=MnO4-;
③在电解池的阴极上是氢离子得电子,在该极上会产生氢气,在流程中,电解产物KOH可以在开始接着利用,即可以循环使用,
故答案为:H2;KOH.
①240℃熔融时发生反应的化学方程式为:2MnO2+O2+4KOH
| ||
故答案为:2MnO2+O2+4KOH
| ||
②在电解池的阳极上是锰酸钾中的阴离子失电子的过程,即MnO42--e-=MnO4-,
故答案为:MnO42--e-=MnO4-;
③在电解池的阴极上是氢离子得电子,在该极上会产生氢气,在流程中,电解产物KOH可以在开始接着利用,即可以循环使用,
故答案为:H2;KOH.
点评:本题考查了电解原理及应用,题目涉及方程式的书写、电解原理的应用和工艺流程的理解,解答本题时要充分理解图中提供的信息,理解了图中信息能对问题做出正确的判断,题目难度中等.

练习册系列答案
相关题目
关于下列有机化合物的说法正确的是( )
| A、溴乙烷和乙烷都是饱和烃 |
| B、甲烷和乙烯都可以与氯气反应 |
| C、高锰酸钾可以氧化苯和甲烷 |
| D、乙烯可以与氢气发生加成反应,苯不能 |
能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是( )
| A、向水中投入一小块金属钠 |
| B、将水加热煮沸 |
| C、向水中加入硝酸铵晶体 |
| D、向水中加食盐晶体 |
某种合成树脂的结构可表示为:
?
则生成该树脂的单体的种类和化学反应所属类型正确的是( )
?

则生成该树脂的单体的种类和化学反应所属类型正确的是( )
| A、1种 加聚反应 |
| B、2种 缩聚反应 |
| C、3种 加聚反应 |
| D、3种 缩聚反应 |
维生素C也称抗坏血酸.人体对维生素C的主要摄入途径是( )
| A、米饭 | B、新鲜水果和蔬菜 |
| C、肉类 | D、牛奶 |