题目内容
能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是( )
| A、向水中投入一小块金属钠 |
| B、将水加热煮沸 |
| C、向水中加入硝酸铵晶体 |
| D、向水中加食盐晶体 |
考点:探究溶液的酸碱性,水的电离
专题:电离平衡与溶液的pH专题
分析:酸或碱抑制水电离,含有弱离子的盐因为水解而促进水电离,所以酸、碱或含有弱离子的盐都影响水的电离,溶液中的c(H+)>c(OH-)说明最终得到的溶液呈酸性,据此分析解答.
解答:
解:酸或碱抑制水电离,含有弱离子的盐因为水解而促进水电离,所以酸、碱或含有弱离子的盐都影响水的电离,溶液中的c(H+)>c(OH-)说明最终得到的溶液呈酸性,
A.向水中投入一小块金属钠,Na和水反应生成NaOH,NaOH抑制水电离,但溶液呈碱性,故A错误;
B.将水煮沸,温度升高促进水电离,但水中c(H+)=c(OH-),溶液呈中性,故B错误;
C.向水中加入硝酸铵,铵根离子水解促进水电离,因为铵根离子水解导致溶液中c(H+)>c(OH-),所以溶液呈酸性,故C正确;
D.向水中加入NaCl,NaCl是强酸强碱盐,不影响水的电离,溶液仍然呈中性,故D错误;
故选C.
A.向水中投入一小块金属钠,Na和水反应生成NaOH,NaOH抑制水电离,但溶液呈碱性,故A错误;
B.将水煮沸,温度升高促进水电离,但水中c(H+)=c(OH-),溶液呈中性,故B错误;
C.向水中加入硝酸铵,铵根离子水解促进水电离,因为铵根离子水解导致溶液中c(H+)>c(OH-),所以溶液呈酸性,故C正确;
D.向水中加入NaCl,NaCl是强酸强碱盐,不影响水的电离,溶液仍然呈中性,故D错误;
故选C.
点评:本题考查水电离的影响因素及溶液酸碱性判断,明确水的电离特点确定影响水电离的物质,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
把铁片放入下列溶液中,铁片溶解,溶液质量增加,也有气体放出的是( )
| A、稀硫酸 |
| B、Fe 2(SO4)3溶液 |
| C、CuSO4溶液 |
| D、NaNO3溶液 |
 ,B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如所示.
,B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如所示.
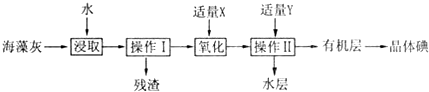
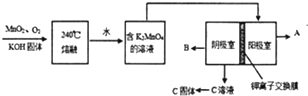
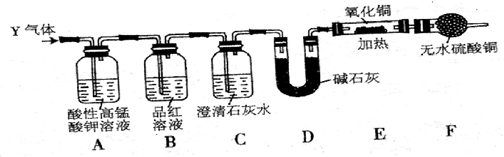
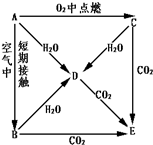 A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按如图所示关系相互转化,已知A金属为单质,C的焰色呈黄色.
A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按如图所示关系相互转化,已知A金属为单质,C的焰色呈黄色.