题目内容
如图是实验室制SO2并验证SO2某些性质的装置图.请填写下列空白:
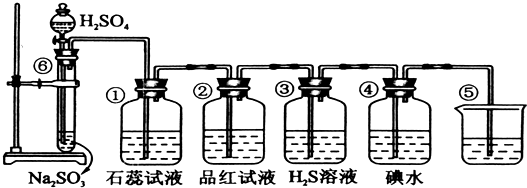
(1)⑥中发生化学反应方程式为 .
(2)①中的实验现象为 ,②中的品红溶液 (填实验现象),证明SO2有 性.
(3)③中的实验现象是 ,证明SO2有 性,发生化学反应方程式为 .④中的实验证明SO2有 性,发生化学反应方程式为 .
(4)⑤中发生化学反应方程式为 .

(1)⑥中发生化学反应方程式为
(2)①中的实验现象为
(3)③中的实验现象是
(4)⑤中发生化学反应方程式为
考点:制备实验方案的设计,实验装置综合,性质实验方案的设计
专题:实验设计题
分析:由图可知,⑥中硫酸与亚硫酸钠反应生成二氧化硫,①中二氧化硫与水反应生成亚硫酸,遇石蕊变红;②中品红溶液褪色;③中二氧化硫与硫化氢发生氧化还原反应生成单质S;④中二氧化硫与碘水发生氧化还原反应生成硫酸和HI酸;⑤为尾气处理装置,二氧化硫与NaOH反应可防止二氧化硫排放在环境中,以此来解答.
解答:
解:(1)⑥中硫酸与亚硫酸钠反应生成二氧化硫气体,反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)①二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象为变红,说明二氧化硫为酸性气体;因二氧化硫具有漂白性,则②中的品红溶液褪色,
故答案为:石蕊溶液变红;红色褪色;漂白;
(3)③中二氧化硫与硫化氢发生氧化还原反应生成单质S,该反应为SO2+2H2S═3S↓+2H2O,实验现象为淡黄色沉淀生成,二氧化硫中S元素的化合价降低,则二氧化硫具有氧化性;④中二氧化硫与碘水发生氧化还原反应生成硫酸和HI酸,该反应为SO2+I2+2H2O═2HI+H2SO4,实验现象为碘水褪色,二氧化硫中S元素的化合价升高,说明二氧化硫具有还原性,
故答案为:淡黄色沉淀生成;氧化;SO2+2H2S═3S↓+2H2O;还原;
(4)⑤中的作用是吸收二氧化硫,防止二氧化硫污染环境,发生的化学反应为SO2+2NaOH═Na2SO3+H2O,
故答案为:SO2+2NaOH═Na2SO3+H2O.
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)①二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象为变红,说明二氧化硫为酸性气体;因二氧化硫具有漂白性,则②中的品红溶液褪色,
故答案为:石蕊溶液变红;红色褪色;漂白;
(3)③中二氧化硫与硫化氢发生氧化还原反应生成单质S,该反应为SO2+2H2S═3S↓+2H2O,实验现象为淡黄色沉淀生成,二氧化硫中S元素的化合价降低,则二氧化硫具有氧化性;④中二氧化硫与碘水发生氧化还原反应生成硫酸和HI酸,该反应为SO2+I2+2H2O═2HI+H2SO4,实验现象为碘水褪色,二氧化硫中S元素的化合价升高,说明二氧化硫具有还原性,
故答案为:淡黄色沉淀生成;氧化;SO2+2H2S═3S↓+2H2O;还原;
(4)⑤中的作用是吸收二氧化硫,防止二氧化硫污染环境,发生的化学反应为SO2+2NaOH═Na2SO3+H2O,
故答案为:SO2+2NaOH═Na2SO3+H2O.
点评:本题考查二氧化硫的制备及性质实验,明确各装置的作用及发生的化学反应是解答本题的关键,注意掌握二氧化硫的性质及检验方法,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
为了证明硫酸亚铁铵[(NH4)2Fe(SO4)26H2O]晶体的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是( )
| A、取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B、取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+ |
| C、取适量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D、取适量硫酸亚铁铵晶体溶于水,得浅绿色溶液,滴入2滴KSCN溶液,溶液不显血红色,再滴入几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+ |
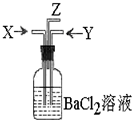 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法不正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法不正确的是( )| A、洗气瓶中产生的沉淀是碳酸钡 |
| B、Z导管出来的气体中含有二氧化碳 |
| C、气瓶中产生的沉淀是硫酸钡 |
| D、Z导管口有红棕色气体出现 |
已知4种无机化合物在水中和液氨中的溶解度(g/100g溶剂)为:
由此溶解度可知在水溶液中上述化合物发生复分解反应为:2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2,那么上述几种化合物在液氨溶液中发生复分解反应的化学方程式( )
| 物质 | AgNO3 | Ba(OH)2 | AgCl | BaCl2 |
| 水中 | 216 | 9.02 | 35.8 | |
| 液氨 | 86 | 97.2 | 0.8 | 0 |
| A、2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2 |
| B、2AgNO3+BaCl2=2AgCl+Ba(NO3)2↓ |
| C、2AgCl+Ba(NO3)2=2AgNO3↓+BaCl2 |
| D、2AgCl+Ba(NO3)2=2AgNO3+BaCl2↓ |
海洋中有丰富的食品、矿产、能源和药物.如图是从海水中提取某些原料的流程图.下列有关说法正确的是( )


| A、从海水中提取物质都必须通过化学反应才能实现 |
| B、第②步属于物理变化 |
| C、从第④~⑤步的目的是浓缩、富集溴单质 |
| D、第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入试剂的顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
 未来生活中金属钛的运用越来越广泛,如可在催化剂TiO2作用下,先用NaClO将CN-(毒性很强)氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用如图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.回答下列问题:
未来生活中金属钛的运用越来越广泛,如可在催化剂TiO2作用下,先用NaClO将CN-(毒性很强)氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用如图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.回答下列问题: 已知苯、溴和溴苯的物理性质如下表所示
已知苯、溴和溴苯的物理性质如下表所示 某同学设计了如图所示的装置(夹持装置已略去),来探究影响化学反应速率的因素.
某同学设计了如图所示的装置(夹持装置已略去),来探究影响化学反应速率的因素.